राउल्ट का नियम इसमें क्या है, सकारात्मक और नकारात्मक विचलन
रौलट का नियम 1887 में फ्रांसीसी रसायनज्ञ फ्रांस्वा-मैरी राउल द्वारा प्रस्तावित किया गया था, और इसमें मौजूद प्रत्येक घटक के आंशिक वाष्प दबाव के आधार पर दो गलत पदार्थों (आमतौर पर आदर्श) के समाधान के वाष्प दबाव के व्यवहार की व्याख्या करने का कार्य करता है।.
रसायन विज्ञान के कानून हैं जो विभिन्न स्थितियों में पदार्थों के व्यवहार का वर्णन करने और वैज्ञानिक रूप से सिद्ध गणितीय मॉडल का उपयोग करके उन घटनाओं को समझाने के लिए उपयोग किए जाते हैं जिनमें वे शामिल हैं। राउल्ट का नियम इनमें से एक है.

वाष्प के दबाव के व्यवहार की भविष्यवाणी करने के लिए गैसों (या तरल पदार्थ) के अणुओं के बीच बातचीत पर आधारित एक स्पष्टीकरण का उपयोग करते हुए, इस कानून का उपयोग गैर-आदर्श या वास्तविक समाधानों का अध्ययन करने के लिए किया जाता है, बशर्ते कि मॉडल को सही करने के लिए आवश्यक गुणांक माना जाता है गणितीय और इसे गैर-आदर्श परिस्थितियों में समायोजित करें.
सूची
- 1 इसमें क्या शामिल है??
- 2 सकारात्मक और नकारात्मक विचलन
- २.१ सकारात्मक विचलन
- २.२ नकारात्मक विचलन
- 3 उदाहरण
- 3.1 मूल मिश्रण
- 3.2 गैर-वाष्पशील विलेय के साथ द्विआधारी मिश्रण
- 4 संदर्भ
इसमें क्या शामिल है??
राउल्ट का नियम इस धारणा पर आधारित है कि इसमें शामिल समाधान एक आदर्श तरीके से व्यवहार करते हैं: ऐसा इसलिए होता है क्योंकि यह कानून इस विचार पर आधारित है कि विभिन्न अणुओं के बीच अंतर-आणविक बल समान अणुओं के बीच समान होते हैं (जो यह वास्तविकता में इतना सफल नहीं है).
वास्तव में, एक समाधान आदर्शता के जितना करीब होता है, उतना ही अधिक अवसर उसे इस कानून द्वारा प्रस्तावित विशेषताओं का पालन करना होगा।.
यह कानून एक गैर-वाष्पशील घोल के साथ वाष्प के दबाव से संबंधित है, जिसमें कहा गया है कि यह उस तापमान पर उस शुद्ध घोल के वाष्प दबाव के बराबर होगा, जो कि दाढ़ के अंश से कई गुना अधिक है। यह एक घटक के लिए गणितीय शब्दों में निम्न तरीके से व्यक्त किया गया है:
पीमैं = पीºमैं . एक्समैं
इस अभिव्यक्ति में पीमैं गैस मिश्रण में घटक i के आंशिक वाष्प दबाव के बराबर है, P vaporमैं शुद्ध घटक i, और X का वाष्प दाब हैमैं मिश्रण में घटक i का मोल अंश है.
उसी तरह, जब आपके पास समाधान में कई घटक होते हैं और वे संतुलन की स्थिति में पहुंच गए हैं, तो आप डाल्टन के साथ राउल्ट के नियम को जोड़कर समाधान के कुल वाष्प दबाव की गणना कर सकते हैं:
P = Pºएकएक्सएक + Pºबीएक्सबी + Pºसीएक्सग...
इसके अलावा, उन समाधानों में जहां केवल एक घुला हुआ पदार्थ और विलायक मौजूद है, कानून नीचे दिखाए गए अनुसार तैयार किया जा सकता है:
पीएक = (1-एक्स)बी) एक्स पीºएक
सकारात्मक और नकारात्मक विचलन
इस कानून के साथ जिन समाधानों का अध्ययन किया जा सकता है, उन्हें आमतौर पर आदर्श रूप से व्यवहार करना चाहिए, क्योंकि उनके अणुओं के बीच बातचीत छोटी होती है और समान गुणों को अपवाद के बिना पूरे समाधान में ग्रहण करने की अनुमति देता है।.
हालांकि, आदर्श समाधान वास्तव में गैर-मौजूद हैं, इसलिए दो गुणांकों को गणना में शामिल किया जाना चाहिए जो अंतर्गर्भाशयी अंतःक्रियाओं का प्रतिनिधित्व करते हैं। ये फुगनेस गुणांक और गतिविधि गुणांक हैं.
इस अर्थ में, राउल्ट के कानून के संबंध में विचलन को सकारात्मक या नकारात्मक के रूप में परिभाषित किया गया है, जो उस समय प्राप्त परिणामों पर निर्भर करता है.
सकारात्मक विचलन
राउल्ट के कानून के संबंध में सकारात्मक विचलन तब होता है जब समाधान का वाष्प दबाव राउल्ट के कानून के साथ गणना से अधिक होता है.
यह तब होता है जब समान अणुओं के बीच सामंजस्य बल विभिन्न अणुओं के बीच समान बलों से अधिक होता है। इस मामले में, दोनों घटक अधिक आसानी से वाष्पन करते हैं.
यह विचलन वाष्प दाब वक्र में किसी विशेष रचना में अधिकतम बिंदु के रूप में देखा जाता है, जो एक सकारात्मक ऐज़ोट्रोप बनाता है.
एजोट्रोप दो या दो से अधिक रासायनिक यौगिकों का एक तरल मिश्रण होता है जो ऐसा व्यवहार करता है जैसे कि यह एक एकल घटक द्वारा बनाया गया हो और जो संरचना को बदले बिना वाष्पित हो जाए.
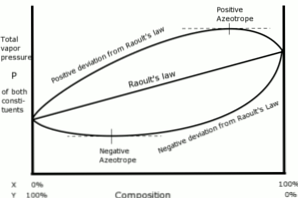
नकारात्मक विचलन
राउल्ट के कानून से नकारात्मक विचलन तब होता है जब कानून के साथ गणना के बाद मिश्रण का वाष्प दबाव अपेक्षा से कम होता है.
ये विचलन तब प्रकट होते हैं जब मिश्रण के अणुओं के बीच सामंजस्य बल तरल पदार्थों के कणों के बीच उनकी शुद्ध अवस्था के औसत बलों से अधिक होता है.
इस प्रकार का विचलन इसकी शुद्ध अवस्था में पदार्थ की तुलना में आकर्षक बलों द्वारा अपनी तरल अवस्था में प्रत्येक घटक की अवधारण को उत्पन्न करता है, ताकि सिस्टम का आंशिक वाष्प दबाव कम हो जाए.
वाष्प दाब घटता में नकारात्मक azeotropes एक न्यूनतम बिंदु का प्रतिनिधित्व करता है, और मिश्रण में दो या दो से अधिक घटकों के बीच संबंध प्रदर्शित करता है।.
उदाहरण
राउल्ट के नियम का उपयोग आमतौर पर अपने अंतर-आणविक बलों के आधार पर एक समाधान के दबाव की गणना करने के लिए किया जाता है, यदि कोई विचलन है और यदि यह सकारात्मक या नकारात्मक होना चाहिए, तो निष्कर्षों की तुलना वास्तविक मूल्यों के साथ करें। राउल्ट के नियम के उपयोग के दो उदाहरण नीचे दिए गए हैं:
मूल मिश्रण
निम्नलिखित मिश्रण, प्रोपेन और ब्यूटेन से मिलकर, वाष्प दबाव के एक अनुमान का प्रतिनिधित्व करता है, और हम यह मान सकते हैं कि दोनों घटक इसके (50-50), 40 डिग्री सेल्सियस के तापमान पर समान अनुपात में हैं:
एक्सप्रोपेन = 0.5
Pºप्रोपेन = 1352.1 केपीए
एक्सबुटान = 0.5
Pºबुटान = 377.6 केपीए
इसकी गणना राउल्ट के नियम से की जाती है:
पीमिश्रण = (0.5 x 377.6 kPa) + (0.5 x 1352.1 kPa)
तो:
पीमिश्रण = 864.8 केपीए
गैर-वाष्पशील विलेय के साथ द्विआधारी मिश्रण
कभी-कभी ऐसा होता है कि मिश्रण का विलेय गैर-वाष्पशील होता है, इसलिए वाष्प दबाव के व्यवहार को समझने के लिए कानून का उपयोग किया जाता है.
95% और 5% के अनुपात में पानी और चीनी के मिश्रण को देखते हुए, और सामान्य तापमान की स्थिति में:
एक्सपानी = 0.95
Pºपानी = 2.34 kPa
एक्सचीनी = 0.05
Pºचीनी = 0 केपीए
इसकी गणना राउल्ट के नियम से की जाती है:
पीमिश्रण = (0.95 x 2.34 kPa) + (0.05 x 0 kPa)
तो:
पीमिश्रण = 2.22 केपीए
स्पष्ट रूप से अंतर-आणविक बलों के प्रभाव के कारण जल वाष्प दबाव का अवसाद रहा है.
संदर्भ
- ऐनी मैरी हेल्मेनस्टाइन, पी। (S.f.)। राउल्ट की विधि परिभाषा। सोचाco.com से लिया गया
- ChemGuide। (एन.डी.)। राउल्ट का नियम और गैर-वाष्पशील विलेय। Chemguide.co.uk से लिया गया
- LibreTexts। (एन.डी.)। राउल्ट्स लॉ एंड लिक्विड का आइडियल मिश्रण। Chem.libretexts.org से लिया गया
- Neutrium। (एन.डी.)। राउल्ट का नियम। Neutrium.net से लिया गया
- विकिपीडिया। (एन.डी.)। राउल्ट का नियम। En.wikipedia.org से लिया गया


