बोहर अभिलक्षणों के परमाणु मॉडल, सीमाएँ, सीमाएँ
बोहर का परमाणु मॉडल डेनिश भौतिक विज्ञानी नील्स बोहर (1885-1962) द्वारा प्रस्तावित परमाणु का प्रतिनिधित्व है। मॉडल बताता है कि इलेक्ट्रॉन परमाणु नाभिक के चारों ओर एक निश्चित दूरी पर कक्षाओं में घूमता है, एक समान परिपत्र गति का वर्णन करता है। कक्षाओं - या ऊर्जा का स्तर, जैसा कि उन्होंने उन्हें बुलाया - विभिन्न ऊर्जा के हैं.
हर बार जब इलेक्ट्रॉन कक्षा में बदलता है, तो वह "क्वांटा" नामक निश्चित मात्रा में ऊर्जा का उत्सर्जन या अवशोषित करता है। बोह्र ने हाइड्रोजन परमाणु द्वारा उत्सर्जित प्रकाश (या अवशोषित) के स्पेक्ट्रम की व्याख्या की। जब एक इलेक्ट्रॉन नाभिक की ओर एक कक्षा से दूसरी कक्षा में जाता है तो ऊर्जा का नुकसान होता है और प्रकाश का उत्सर्जन होता है, जिसमें तरंग दैर्ध्य और विशेषताएं होती हैं.

बोह्र ने इलेक्ट्रॉन के ऊर्जा स्तर को गिना, यह देखते हुए कि इलेक्ट्रॉन नाभिक के करीब है, इसकी ऊर्जा की स्थिति कम है। इस तरह, इलेक्ट्रॉन नाभिक से जितना दूर होगा, ऊर्जा स्तर उतनी ही अधिक होगा और इसलिए ऊर्जा अवस्था अधिक होगी.
सूची
- 1 मुख्य विशेषताएं
- १.१ यह समय के अन्य मॉडल और सिद्धांतों पर आधारित है
- 1.2 प्रायोगिक साक्ष्य
- 1.3 इलेक्ट्रॉन ऊर्जा के स्तर में मौजूद हैं
- 1.4 ऊर्जा के बिना इलेक्ट्रॉन की कोई गति नहीं होती है
- प्रत्येक परत में 1.5 इलेक्ट्रॉनों की संख्या
- 1.6 इलेक्ट्रॉनों ऊर्जा के विकिरण के बिना गोलाकार कक्षाओं में घूमते हैं
- 1.7 अनुमत परिक्रमा
- 1.8 ऊर्जा उत्सर्जित या जंप में अवशोषित
- बोहर परमाणु मॉडल के 2 पोस्टुलेट
- २.१ पहला आसन
- २.२ दूसरा पद
- २.३ तीसरा पद
- 3 हाइड्रोजन परमाणुओं के लिए ऊर्जा स्तर का आरेख
- 4 बोहर मॉडल की 3 मुख्य सीमाएँ
- रुचि के 5 लेख
- 6 संदर्भ
मुख्य विशेषताएं
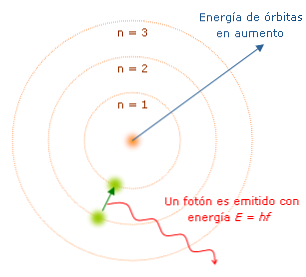
बोहर मॉडल की विशेषताएं महत्वपूर्ण हैं क्योंकि उन्होंने अधिक पूर्ण परमाणु मॉडल के विकास की दिशा में मार्ग निर्धारित किया है। मुख्य हैं:
यह उस समय के अन्य मॉडलों और सिद्धांतों पर आधारित है
बोहर का मॉडल रदरफोर्ड के परमाणु मॉडल और अल्बर्ट आइंस्टीन के फोटोइलेक्ट्रिक प्रभाव से लिए गए विचारों द्वारा समर्थित क्वांटम सिद्धांत को शामिल करने वाला पहला था। वास्तव में आइंस्टीन और बोहर दोस्त थे.
प्रायोगिक साक्ष्य
इस मॉडल के अनुसार, परमाणु केवल विकिरण को अवशोषित या उत्सर्जित करते हैं, जब इलेक्ट्रॉनों को अनुमत कक्षाओं के बीच कूदते हैं। जर्मन भौतिकविदों जेम्स फ्रेंक और गुस्ताव हर्ट्ज़ ने 1914 में इन राज्यों के प्रायोगिक साक्ष्य प्राप्त किए.
इलेक्ट्रॉनों ऊर्जा स्तरों में मौजूद हैं
इलेक्ट्रॉन नाभिक को घेर लेते हैं और कुछ ऊर्जा स्तरों पर मौजूद होते हैं, जो असतत होते हैं और जिन्हें क्वांटम संख्या में वर्णित किया जाता है.
इन स्तरों का ऊर्जा मूल्य एक संख्या n के एक फ़ंक्शन के रूप में मौजूद है, जिसे मुख्य क्वांटम संख्या कहा जाता है, जिसे बाद में विस्तृत किए जाने वाले समीकरणों के साथ गणना की जा सकती है.
ऊर्जा के बिना इलेक्ट्रॉन की कोई गति नहीं है
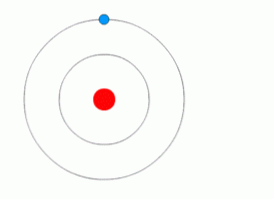
ऊपर दिया गया चित्रण एक इलेक्ट्रॉन को दर्शाता है जो क्वांटम कूदता है.
इस मॉडल के अनुसार, ऊर्जा के बिना इलेक्ट्रॉन का एक स्तर से दूसरे स्तर पर कोई संचलन नहीं होता है, जैसे ऊर्जा के बिना किसी वस्तु को गिराना संभव नहीं है, जो दो मैग्नेट गिर गई हो या अलग हो गई हो.
बोह्र ने एक इलेक्ट्रॉन से दूसरे स्तर तक पारित करने के लिए एक इलेक्ट्रॉन द्वारा आवश्यक ऊर्जा के रूप में क्वांटम का सुझाव दिया। उन्होंने यह भी कहा कि एक इलेक्ट्रॉन द्वारा कब्जा किए गए सबसे कम ऊर्जा स्तर को "ग्राउंड स्टेट" कहा जाता है। "उत्तेजित अवस्था" एक अधिक अस्थिर अवस्था है, जो इलेक्ट्रॉन के उच्च ऊर्जा कक्षीय होने के परिणामस्वरूप होती है.
प्रत्येक परत में इलेक्ट्रॉनों की संख्या
प्रत्येक परत में फिट होने वाले इलेक्ट्रॉनों की गणना 2n के साथ की जाती है2
रासायनिक तत्व जो आवधिक तालिका का हिस्सा होते हैं और जो एक ही स्तंभ में होते हैं, उनमें अंतिम परत में समान इलेक्ट्रॉन होते हैं। पहले चार परतों में एलेक्रोन की संख्या 2, 8, 18 और 32 होगी.
इलेक्ट्रॉनों ऊर्जा के विकिरण के बिना वृत्ताकार कक्षाओं में घूमते हैं
बोह्र्स फर्स्ट पोस्टुलेट के अनुसार, इलेक्ट्रॉनों ऊर्जा के विकिरण के बिना परमाणु के नाभिक के चारों ओर गोलाकार कक्षाओं का वर्णन करते हैं.
कक्षाओं की अनुमति दी
बोह्र के दूसरे पोस्टुलेट के अनुसार, इलेक्ट्रॉन के लिए केवल अनुमत कक्ष हैं, जिनके लिए इलेक्ट्रॉन का कोणीय गति एल प्लैंक स्थिरांक का पूर्णांक एकाधिक है। गणितीय रूप से इसे इस तरह व्यक्त किया जाता है:
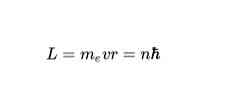
ऊर्जा उत्सर्जित या चुटकियों में अवशोषित होती है
थर्ड पोस्टुलेट के अनुसार, इलेक्ट्रॉन एक कक्षा से दूसरी कक्षा में कूदने में ऊर्जा का उत्सर्जन या अवशोषित करेंगे। कक्षा की छलांग में एक फोटॉन उत्सर्जित या अवशोषित होता है, जिसकी ऊर्जा का गणितीय रूप से प्रतिनिधित्व किया जाता है:
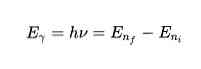
बोहर परमाणु मॉडल के पोस्टुलेट्स
बोह्र ने परमाणु के ग्रहीय मॉडल को निरंतरता प्रदान की, जिसके अनुसार इलेक्ट्रॉनों ने एक सकारात्मक रूप से चार्ज किए गए नाभिक के साथ-साथ सूर्य के चारों ओर ग्रहों की परिक्रमा की।.
हालाँकि, यह मॉडल शास्त्रीय भौतिकी के किसी एक पद को चुनौती देता है। इसके अनुसार, एक विद्युत आवेश (इलेक्ट्रॉन की तरह) वाला एक कण जो एक वृत्ताकार पथ में चलता है, उसे विद्युत चुम्बकीय विकिरण के उत्सर्जन से लगातार ऊर्जा खोनी चाहिए। ऊर्जा खोने पर, इलेक्ट्रॉन को नाभिक में गिरने तक एक सर्पिल का पालन करना होगा.
बोह्र ने यह माना कि शास्त्रीय भौतिकी के नियम परमाणुओं में देखी गई स्थिरता का वर्णन करने के लिए सबसे उपयुक्त नहीं थे और उन्होंने निम्नलिखित पोस्टिंग प्रस्तुत की:
पहला आसन
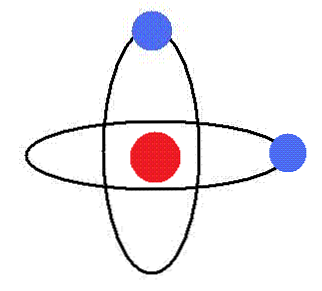
इलेक्ट्रॉन, बिना विकिरण ऊर्जा के, परिक्रमा कक्षाओं में नाभिक के चारों ओर घूमता है। इन कक्षाओं में कक्षीय कोणीय गति स्थिर है.
एक परमाणु के इलेक्ट्रॉनों के लिए केवल कुछ निश्चित ऊर्जा स्तरों के अनुरूप ही कुछ रेडी की कक्षाओं की अनुमति होती है.
दूसरा आसन
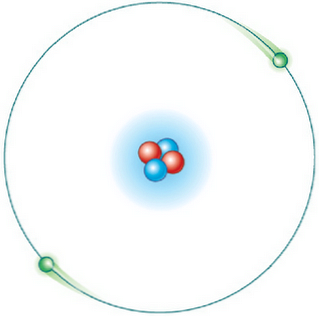
सभी परिक्रमाएं संभव नहीं हैं। लेकिन एक बार इलेक्ट्रॉन एक ऐसी कक्षा में होता है जिसे अनुमति दी जाती है, यह विशिष्ट और स्थिर ऊर्जा की स्थिति में है और ऊर्जा का उत्सर्जन नहीं करता है (स्थिर ऊर्जा कक्षा).
उदाहरण के लिए, हाइड्रोजन परमाणु में इलेक्ट्रॉन के लिए अनुमत ऊर्जा निम्नलिखित समीकरण द्वारा दी गई है:
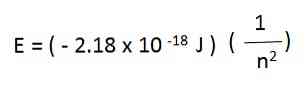
हाइड्रोजन परमाणु की इलेक्ट्रॉन ऊर्जाएं जो उपरोक्त समीकरण से उत्पन्न होती हैं, n के प्रत्येक मान के लिए ऋणात्मक होती हैं। जैसा कि एन बढ़ता है, ऊर्जा कम नकारात्मक है और, इसलिए, बढ़ जाती है.
जब n बड़ा पर्याप्त है-उदाहरण के लिए, n = the-ऊर्जा शून्य है और यह दर्शाता है कि इलेक्ट्रॉन को छोड़ दिया गया है और आयनित परमाणु है। शून्य ऊर्जा की यह स्थिति नकारात्मक ऊर्जा वाले राज्यों की तुलना में अधिक ऊर्जा प्राप्त करती है.
तीसरा आसन
एक इलेक्ट्रॉन ऊर्जा को उत्सर्जित या अवशोषित करके एक स्थिर ऊर्जा कक्षा से दूसरी में बदल सकता है.
उत्सर्जित या अवशोषित ऊर्जा दोनों राज्यों के बीच ऊर्जा अंतर के बराबर होगी। यह ऊर्जा E एक फोटॉन के रूप में है और निम्नलिखित समीकरण द्वारा दी गई है:
ई = एच ν
इस समीकरण में E ऊर्जा (अवशोषित या उत्सर्जित) है, h प्लैंक स्थिरांक है (इसका मान 6.63 x 10 है-34 जूल-सेकंड [जे-एस]) और ν प्रकाश की आवृत्ति है, जिसकी इकाई 1 / s है.
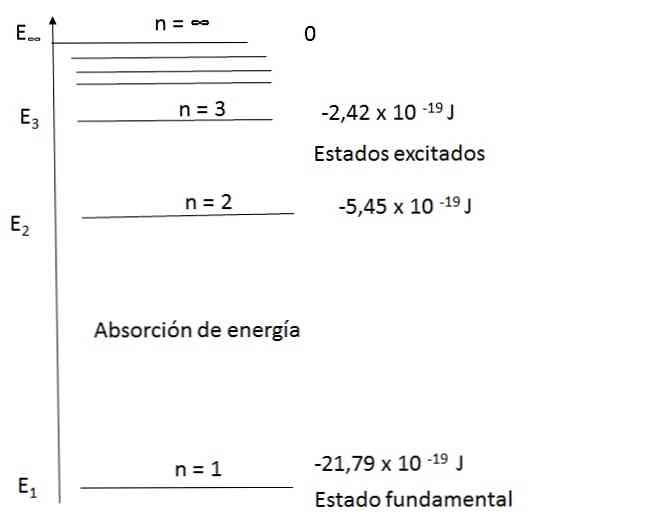
हाइड्रोजन परमाणुओं के लिए ऊर्जा स्तर का आरेख
बोहर मॉडल हाइड्रोजन परमाणु के स्पेक्ट्रम को संतोषजनक ढंग से समझाने में सक्षम था। उदाहरण के लिए, दृश्यमान प्रकाश की तरंग दैर्ध्य की सीमा में, हाइड्रोजन परमाणु का उत्सर्जन स्पेक्ट्रम निम्नानुसार है:
आइए देखें कि आप कुछ मनाया प्रकाश बैंडों की आवृत्ति की गणना कैसे कर सकते हैं; उदाहरण के लिए, रंग लाल.
पहले समीकरण का उपयोग करते हुए और 2 और 3 के लिए n को प्रतिस्थापित करने से आपको आरेख में दिखाई देने वाले परिणाम मिलते हैं.

वह है:
एन = 2, ई के लिए2 = -5.45 x 10-19 जम्मू
एन = 3 के लिए, ई3 = -2.42 x 10-19 जम्मू
फिर दो स्तरों के लिए ऊर्जा अंतर की गणना करना संभव है:
EE = ई3 - ए2 = (-2.42 - (- 5,45)) x 10 - 19 = 3.43 x 10 - 19 जम्मू
तीसरे पदावनत में वर्णित समीकरण के अनुसार hE = h ν। फिर, आप ν (प्रकाश की आवृत्ति) की गणना कर सकते हैं:
ν = ΔE / एच
वह है:
ν = 3.43 x 10-19 जे / ६.६३ x १०-34 जे-रों
ν = 4.56 x 1014 रों-1 या 4.56 x 1014 हर्ट्ज
Λ = c / ν होने के नाते, और प्रकाश की गति c = 3 x 10 8 मी / एस, तरंग दैर्ध्य द्वारा दिया जाता है:
λ = 6,565 x 10 - 7 मी (656.5 एनएम)
यह हाइड्रोजन लाइनों के स्पेक्ट्रम में देखे गए लाल बैंड का तरंग दैर्ध्य मूल्य है.
बोहर मॉडल की 3 मुख्य सीमाएँ
1- यह हाइड्रोजन परमाणु के वर्णक्रम के अनुरूप है लेकिन अन्य परमाणुओं के वर्णक्रम में नहीं.
2- इलेक्ट्रॉन के अघुलनशील गुणों को परमाणु कण के चारों ओर घूमने वाले एक छोटे कण के रूप में इसका वर्णन नहीं किया गया है.
3- बोह्र यह समझाने में विफल है कि शास्त्रीय विद्युत चुंबकत्व उनके मॉडल पर क्यों लागू नहीं होता है। यही कारण है कि, जब वे स्थिर कक्षा में होते हैं, तो इलेक्ट्रॉन विद्युत चुम्बकीय विकिरण का उत्सर्जन नहीं करते हैं.
रुचि के लेख
श्रोडिंगर का परमाणु मॉडल.
ब्रोगली का परमाणु मॉडल.
चाडविक का परमाणु मॉडल.
हाइजेनबर्ग का परमाणु मॉडल.
पेरिन का परमाणु मॉडल.
थॉमसन का परमाणु मॉडल.
डाल्टन का परमाणु मॉडल.
डीराक जॉर्डन का परमाणु मॉडल.
डेमोक्रिटस का परमाणु मॉडल.
संदर्भ
- ब्राउन, टी। एल। (2008)। रसायन विज्ञान: केंद्रीय विज्ञान। ऊपरी सैडल नदी, एनजे: पियर्सन अप्रेंटिस हॉल
- आइज़बर्ग, आर।, और रेसनिक, आर। (2009). परमाणुओं, अणुओं, ठोस, नाभिक और कणों की क्वांटम भौतिकी. न्यूयॉर्क: विली
- बोहर-सोमरफेल्ड का परमाणु मॉडल। से लिया गया: fisquiweb.es
- जोस्टेन, एम। (1991)। रसायन विज्ञान की दुनिया फिलाडेल्फिया, पा।: सॉन्डर्स कॉलेज प्रकाशन, पीपी। 6-78.
- मोडेल डी बोह्र डी ल'टोमे डीहाइड्रोजेन। Fr.khanacademy.org से लिया गया
- इज़लर, के। रेट्रोस्पेक्टिव सर ल'टोम: ले मोडेल डे बोह्र ए सेंट ए। से लिया गया: home.cern



