एथिल ईथर गुण, संरचना, प्राप्त करना, उपयोग करता है
एथिल ईथर, डायथाइल ईथर के रूप में भी जाना जाता है, एक कार्बनिक यौगिक है जिसका रासायनिक सूत्र सी है4एच10ओ। यह रंगहीन और वाष्पशील तरल होने के कारण होता है, और इसलिए, इसकी बोतलों को संभवत: बंद रखा जाना चाहिए.
इस ईथर को डायलकाइल ईथर के एक सदस्य के रूप में वर्गीकृत किया गया है; यही है, उनके पास सूत्र ROR 'है, जहां R और R' अलग-अलग कार्बन खंडों का प्रतिनिधित्व करते हैं। और जैसा कि इसके मध्य नाम का वर्णन है, डायथाइल ईथर, दो कट्टरपंथी-एथिल हैं जो ऑक्सीजन परमाणु को बांधते हैं.

प्रारंभ में एथिल ईथर का उपयोग एक सामान्य संवेदनाहारी के रूप में किया गया था, जिसे 1846 में विलियम थॉमस ग्रीन मॉर्टन द्वारा प्रस्तुत किया गया था। हालांकि, इसकी ज्वलनशीलता के कारण, इसका उपयोग अस्वीकार कर दिया गया था, इसे अन्य कम खतरनाक एनेस्थेटिक्स के साथ बदल दिया गया था।.
इस यौगिक का उपयोग रक्त परिसंचरण के समय का अनुमान लगाने के लिए किया गया है, रोगियों के हृदय की स्थिति के आकलन के दौरान.
शरीर के भीतर, डायथाइल ईथर को कार्बन डाइऑक्साइड और मेटाबोलाइट्स में बदला जा सकता है; बाद का अंत मूत्र में उत्सर्जित हो रहा है। हालांकि, प्रशासित अधिकांश ईथर बिना किसी संशोधन के गुजरते हुए, फेफड़ों में उत्सर्जित होते हैं.
दूसरी ओर, इसका उपयोग साबुन, तेल, इत्र, एल्कलॉइड और मसूड़ों के लिए विलायक के रूप में किया जाता है.
सूची
- 1 एथिल ईथर की संरचना
- १.१ अंतर-आणविक बल
- 2 भौतिक और रासायनिक गुण
- २.१ अन्य नाम
- २.२ आणविक सूत्र
- 2.3 आणविक भार
- २.४ शारीरिक रूप
- 2.5 गंध
- 2.6 स्वाद
- 2.7 क्वथनांक
- 2.8 गलनांक
- 2.9 फ़्लैश बिंदु
- 2.10 पानी में घुलनशीलता
- 2.11 अन्य तरल पदार्थों में घुलनशीलता
- 2.12 घनत्व
- 2.13 वाष्प घनत्व
- 2.14 वाष्प दाब
- 2.15 स्थिरता
- 2.16 ऑटो इग्निशन
- 2.17 अपघटन
- 2.18 विस्कोसिटी
- 2.19 दहन की गर्मी
- 2.20 वाष्पीकरण गर्मी
- 2.21 सतह तनाव
- 2.22 आयनीकरण क्षमता
- 2.23 गंध दहलीज
- 2.24 अपवर्तक सूचकांक
- ३ प्राप्त करना
- 3.1 एथिल अल्कोहल से
- 3.2 एथिलीन से
- 4 विषाक्तता
- 5 का उपयोग करता है
- 5.1 कार्बनिक विलायक
- 5.2 सामान्य संज्ञाहरण
- 5.3 ईथर की आत्मा
- 5.4 रक्त परिसंचरण का मूल्यांकन
- 5.5 शिक्षण प्रयोगशालाएँ
- 6 संदर्भ
एथिल ईथर की संरचना
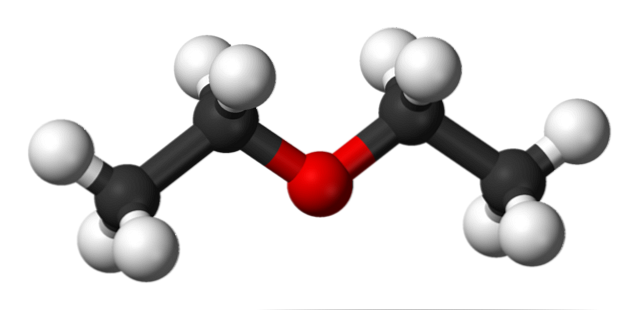
ऊपर की छवि में हमारे पास एथिल ईथर की आणविक संरचना के गोले और सलाखों के मॉडल के साथ एक प्रतिनिधित्व है.
जैसा कि देखा जा सकता है, ऑक्सीजन क्षेत्र के अनुरूप लाल क्षेत्र, दोनों पक्षों पर दो एथिल समूह जुड़े हुए हैं। सभी लिंक कुल्हाड़ियों के चारों ओर सरल, लचीले और स्वतंत्र रूप से घूमने योग्य हैं.
इन घुमावों की उत्पत्ति स्टीरियो के रूप में की जाने वाली स्टीरियोइसमर्स से होती है; आइसोमर्स से अधिक, वे वैकल्पिक स्थानिक राज्य हैं। छवि की संरचना बिल्कुल विरोधी कंफ़र्मर से मेल खाती है, जिसमें परमाणुओं के सभी समूह कंपित हो जाते हैं (एक दूसरे से अलग हो जाते हैं).
अन्य कंफर्मर क्या होगा? ग्रहण किया, और हालांकि आपकी छवि उपलब्ध नहीं है, बस इसे यू आकार के साथ कल्पना करें। यू के ऊपरी छोर पर मिथाइल समूह स्थित होंगे, -सीएच3, जो स्थैतिक प्रतिकर्षण का अनुभव करेंगे (वे अंतरिक्ष में टकराएंगे).
इसलिए, यह अपेक्षित है कि सीएच अणु3सीएच2OCH2सीएच3 ज्यादातर समय विरोधी रचना को अपनाएं.
इंटरमॉलिक्युलर फोर्स
तरल अवस्था में शासित एथिल ईथर के अणु किस इंटरमोलॉजिकल बलों द्वारा होते हैं? वे तरल में मुख्य रूप से फैलाव बलों के लिए धन्यवाद बनाए रखते हैं, क्योंकि उनके द्विध्रुवीय क्षण (1.5D) में इलेक्ट्रॉनिक घनत्व (δ +) में पर्याप्त क्षेत्र की कमी होती है
ऐसा इसलिए है क्योंकि इथाइल समूहों का कोई भी कार्बन परमाणु ऑक्सीजन परमाणु को बहुत अधिक इलेक्ट्रॉन घनत्व नहीं देता है। ऊपर हाथ (नीचे छवि) में एथिल ईथर के इलेक्ट्रोस्टैटिक क्षमता के नक्शे से स्पष्ट है। नीले क्षेत्र की अनुपस्थिति पर ध्यान दें.
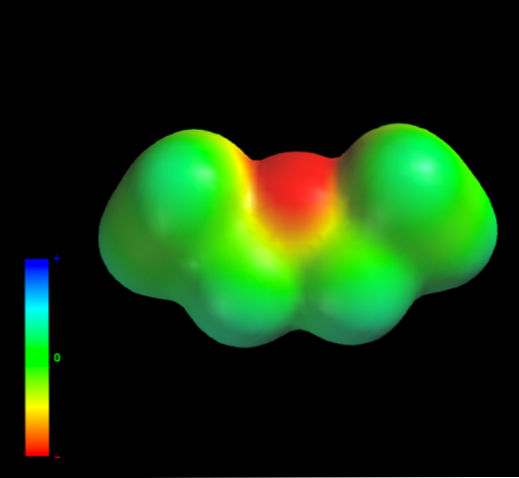
ऑक्सीजन हाइड्रोजन बांड को या तो फिर से नहीं बना सकता है, क्योंकि आणविक संरचना में उपलब्ध ओ-एच बांड नहीं हैं। इसलिए, यह तात्कालिक द्विध्रुवीय और उनके आणविक द्रव्यमान हैं जो उनके फैलाव बलों का पक्ष लेते हैं.
इसके बावजूद, यह पानी में अत्यधिक घुलनशील है। क्यों? क्योंकि इसकी ऑक्सीजन परमाणु, एक उच्च इलेक्ट्रॉन घनत्व के साथ, एक पानी के अणु से हाइड्रोजन बांड को स्वीकार कर सकती है:
(सीएच3सीएच2)2हेδ- - δ+एच-ओह
ये सहभागिता 100 मीटर पानी में घुलने वाले इस ईथर के 6.04 ग्राम के लिए जिम्मेदार हैं.
भौतिक और रासायनिक गुण
अन्य नाम
-डायथाइल ईथर
-ethoxyethane
-एथिल ऑक्साइड
आणविक सूत्र
सी4एच10ओ या (सी)2एच5)2हे.
आणविक भार
74.14 ग्राम / मोल.
शारीरिक रूप
रंगहीन तरल.
गंध
मीठा और मसालेदार.
स्वाद
जलन और मीठा.
क्वथनांक
94.3 toF (34.6 )C) से 760 mmHg.
गलनांक
-177.3 7F (-116.3 .C)। स्थिर क्रिस्टल.
इग्निशन पॉइंट
-49F (बंद कंटेनर).
पानी में घुलनशीलता
25 gC पर 6.04 g / 100mL.
अन्य तरल पदार्थों में घुलनशीलता
लघु-श्रृंखला स्निग्ध अल्कोहल, बेंजीन, क्लोरोफॉर्म, पेट्रोलियम ईथर, वसा विलायक, कई तेलों और केंद्रित हाइड्रोक्लोरिक एसिड के साथ गलत.
एसीटोन में घुलनशील और इथेनॉल में बहुत घुलनशील। यह नेफ्था, बेंजीन और तेलों में भी घुलनशील है.
घनत्व
68 /F (20 LC) पर 0.714 मिलीग्राम / एमएल.
वाष्प का घनत्व
2.55 (घनत्व 1 के साथ ली गई हवा के संबंध में).
भाप का दबाव
44º mmHg 68 44F पर। 25 ° C पर 538 mmHg। 20। सी पर 58.6 केपीए.
स्थिरता
पेरोक्साइड के गठन के साथ हवा, नमी और प्रकाश की क्रिया द्वारा इसे धीरे-धीरे ऑक्सीकरण किया जाता है.
पेरोक्साइड का गठन ईथर के कंटेनरों में हो सकता है जिन्हें खोला गया है और जो छह महीने से अधिक समय तक भंडारण में रहते हैं। पेरोक्साइड्स घर्षण, प्रभाव या हीटिंग द्वारा विस्फोट कर सकते हैं.
इसके साथ संपर्क से बचें: जस्ता, हैलोजेन, गैर-धातु ऑक्सीलेहाइड, मजबूत ऑक्सीकरण एजेंट, क्रोमाइल क्लोराइड, टेंटिन तेल, नाइट्रेट और धातु क्लोराइड.
ऑटो इग्निशन
356 35F (180ºC).
सड़न
गर्म होने पर यह विघटित हो जाता है, एक तीखा और परेशान करने वाला धुआँ उत्सर्जित करता है.
चिपचिपापन
20 48 सी पर 0.2448 cPoise.
दहन की गर्मी
8,807 किलो कैलोरी / जी.
वाष्पीकरण गर्मी
30.8C पर 89.8 कैल / जी.
सतह तनाव
20º C पर 17.06 dynes / cm.
आयनीकरण की क्षमता
9.53 ई.वी..
गंध दहलीज
0.83 पीपीएम (शुद्धता नहीं दी गई है).
अपवर्तनांक
1535 º पर 1,355.
प्राप्त करने के
एथिल अल्कोहल से
एथिल अल्हड़ एथिल अल्कोहल से प्राप्त किया जा सकता है, एक उत्प्रेरक के रूप में सल्फ्यूरिक एसिड की उपस्थिति में। जलीय माध्यम में सल्फ्यूरिक एसिड हाइड्रोनियम आयन, एच का उत्पादन करता है3हे+.
निर्जल एथिल अल्कोहल सल्फ्यूरिक एसिड समाधान के माध्यम से बहता है, 130 डिग्री सेल्सियस और 140 डिग्री सेल्सियस के बीच गर्म होता है, जो एथिल अल्कोहल अणुओं के प्रोटॉन का उत्पादन करता है। इसके बाद, गैर-प्रोटॉनयुक्त एथिल अल्कोहल का एक और अणु प्रोटॉन के अणु के साथ प्रतिक्रिया करता है.
जब ऐसा होता है, तो एथिल अल्कोहल के दूसरे अणु के न्यूक्लियोफिलिक हमले से पहले अणु (एक प्रोटॉन) से पानी की रिहाई को बढ़ावा मिलता है; नतीजतन, एक प्रोटेक्टेड एथिल ईथर बनता है (सीएच)3सीएच2OHCH2सीएच3), आंशिक रूप से चार्ज ऑक्सीजन सकारात्मक के साथ.
हालांकि, संश्लेषण की यह विधि दक्षता खो देती है क्योंकि सल्फ्यूरिक एसिड प्रक्रिया में उत्पादित पानी से पतला होता है (एथिल अल्कोहल के निर्जलीकरण का उत्पाद).
प्रतिक्रिया का तापमान महत्वपूर्ण है। 130 डिग्री सेल्सियस से नीचे के तापमान पर, प्रतिक्रिया धीमी है और अधिकांश भाग के लिए एथिल अल्कोहल आसुत होगा.
150 ° C से ऊपर, सल्फ्यूरिक एसिड एथिल अल्कोहल बनाने के लिए एथिल अल्कोहल के साथ संयोजन के बजाय एथिलीन (डबल बॉन्ड एल्केन) के गठन का कारण बनता है।.
एथिलीन से
विपरीत प्रक्रिया में, अर्थात, वाष्प चरण में एथिलीन का जलयोजन, एथिल अल्कोहल के अलावा एथिल ईथर को बायप्रोडक्ट के रूप में बनाया जा सकता है। वास्तव में, यह सिंथेटिक मार्ग इस कार्बनिक यौगिक का अधिकांश उत्पादन करता है.
इस प्रक्रिया में फॉस्फोरिक एसिड उत्प्रेरक का उपयोग एक ठोस समर्थन के लिए किया जाता है, जो अधिक ईथर उत्पादन करने के लिए समायोजित करने में सक्षम है.
एल्यूमिना उत्प्रेरक की उपस्थिति में इथेनॉल के वाष्प चरण में निर्जलीकरण, एथेरिक ईथर के उत्पादन में 95% उपज दे सकता है.
विषाक्तता
यह संपर्क द्वारा त्वचा और आंखों पर जलन पैदा कर सकता है। त्वचा के साथ संपर्क इसके सूखने और टूटने का कारण बन सकता है। ईथर आमतौर पर त्वचा में प्रवेश नहीं करता है, क्योंकि यह जल्दी से वाष्पित हो जाता है.
ईथर के कारण होने वाली आंखों की जलन आमतौर पर हल्की होती है, और गंभीर जलन के मामले में, क्षति आमतौर पर प्रतिवर्ती होती है.
इसका अंतर्ग्रहण मादक प्रभाव और पेट में जलन पैदा करता है। गंभीर घूस गुर्दे की क्षति का कारण बन सकता है.
ईथर के साँस लेने से नाक और गले में जलन हो सकती है। ईथर की साँस लेना के मामले में हो सकता है: उनींदापन, उत्तेजना, चक्कर आना, उल्टी, अनियमित श्वास और बढ़ा हुआ लार।.
उच्च जोखिम से चेतना का नुकसान हो सकता है और मृत्यु भी हो सकती है.
OSHA 8 घंटे की शिफ्ट के दौरान औसतन 800 पीपीएम की एक व्यावसायिक जोखिम सीमा स्थापित करता है.
आंखों की जलन के स्तर: 100 पीपीएम (मानव)। आंखों की जलन के स्तर: 1200 मिलीग्राम / मी3 (400 पीपीएम).
अनुप्रयोगों
कार्बनिक विलायक
यह एक कार्बनिक विलायक है जो ब्रोमीन, आयोडीन और अन्य हैलोजेन को भंग करने के लिए उपयोग किया जाता है; अधिकांश लिपिड (वसा), रेजिन, शुद्ध घिसने वाले, कुछ अल्कलॉइड, मसूड़े, इत्र, सेल्यूलोज एसीटेट, सेल्यूलोज नाइट्रेट, हाइड्रोकार्बन और रंजक.
इसके अलावा, इसका उपयोग जानवरों के ऊतकों और पौधों के सक्रिय सिद्धांतों के निष्कर्षण में किया जाता है, क्योंकि इसमें पानी की तुलना में कम घनत्व होता है और इस पर तैरता है, जिससे वांछित पदार्थ ईथर में घुल जाते हैं।.
सामान्य संज्ञाहरण
यह 1840 के बाद से एक सामान्य संवेदनाहारी के रूप में इस्तेमाल किया गया है, चिकित्सीय लाभ के लिए क्लोरोफॉर्म की जगह। हालांकि, यह एक ज्वलनशील पदार्थ है, और इसलिए, नैदानिक सेटिंग्स के भीतर इसके उपयोग के लिए गंभीर कठिनाइयों का सामना करता है.
इसके अलावा, यह रोगियों में कुछ अवांछनीय पोस्टऑपरेटिव साइड इफेक्ट्स जैसे मतली और उल्टी पैदा करता है.
इन कारणों के लिए, सामान्य संवेदनाहारी के रूप में ईथर का उपयोग छोड़ दिया गया है, इसे अन्य एनेस्थेटिक्स जैसे कि हैलथेन के साथ बदल दिया गया है।.
ईथर की आत्मा
इथेनॉल के साथ मिश्रित ईथर का उपयोग ईथर की भावना नामक घोल को बनाने के लिए किया जाता था, जिसका उपयोग गैस्ट्रिक पेट फूलने और जठरांत्र के दुग्ध रूपों के उपचार में किया जाता था।.
रक्त परिसंचरण का मूल्यांकन
ईथर का उपयोग एक हाथ और फेफड़े के बीच रक्त परिसंचरण का मूल्यांकन करने के लिए किया गया है। ईथर को एक बांह में इंजेक्ट किया जाता है, जिससे रक्त को सही आलिंद में लाया जाता है, फिर दाएं वेंट्रिकल को और वहां से फेफड़ों तक.
उत्सर्जित हवा में ईथर की गंध के आगे, ईथर के इंजेक्शन से निकलने वाला समय लगभग 4 से 6 s है.
शिक्षण प्रयोगशालाएँ
ईथर का प्रयोग प्रयोगशालाओं में कई प्रयोग सिखाने में किया जाता है; उदाहरण के लिए, मेंडेल के आनुवांशिकी के नियमों के प्रदर्शन में.
ईथर का उपयोग जीनस ड्रोसोफिला की मक्खियों को सुन्न करने और उनके बीच आवश्यक क्रॉसिंग की अनुमति देने के लिए किया जाता है, ताकि सबूतों को आनुवंशिकी के नियमों में रखा जा सके।
संदर्भ
- ग्राहम सोलोमन्स टी। डब्ल्यू।, क्रेग बी। फ्राइले। (2011)। कार्बनिक रसायन। Amines। (10वें संस्करण।)। विली प्लस.
- केरी एफ (2008)। कार्बनिक रसायन (छठा संस्करण)। मैक ग्रे हिल.
- सेवियर। (2018)। डायथाइल ईथर। विज्ञान प्रत्यक्ष। से लिया गया: scoubleirect.com
- एनसाइक्लोपीडिया ब्रिटानिका के संपादक। (2018)। एथिल ईथर। ब्रिटानिका ncyclopædia। से लिया गया: britannica.com
- पबकेम (2018)। ईथर। से लिया गया: pubchem.ncbi.nlm.nih.gov
- विकिपीडिया। (2018)। डायथाइल ईथर। से लिया गया: en.wikipedia.org
- सुरक्षा शीट XI: एथिल ईथर। [PDF]। से पुनर्प्राप्त: quimica.unam.mx


