एक तटस्थ परमाणु क्या है? (इसके साथ)
एक तटस्थ परमाणु वह है, जिसके प्रोटॉन और इलेक्ट्रॉनों की संख्या के बीच मुआवजे के कारण विद्युत आवेश का अभाव है। दोनों विद्युत रूप से चार्ज किए गए उप-परमाणु कण हैं.
प्रोटॉन न्यूट्रॉन के बगल में बढ़ जाते हैं, और नाभिक बनाते हैं; जबकि इलेक्ट्रॉनों को एक इलेक्ट्रॉनिक क्लाउड को परिभाषित करके अलग किया जाता है। जब परमाणु में प्रोटॉनों की संख्या, उसके परमाणु संख्या (Z) के बराबर, इलेक्ट्रॉनों की संख्या के बराबर होती है, तो यह कहा जाता है कि परमाणु के भीतर विद्युत आवेशों के बीच क्षतिपूर्ति होती है।.
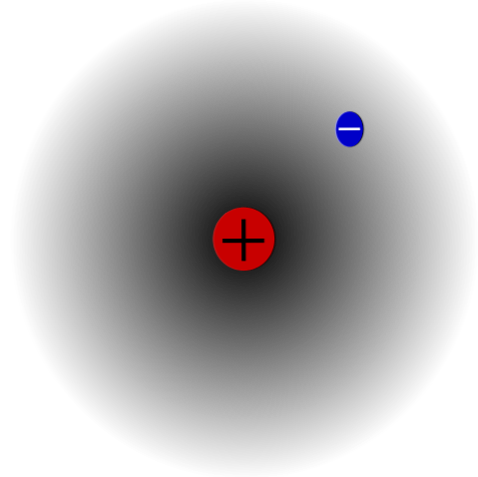
उदाहरण के लिए, एक हाइड्रोजन परमाणु (ऊपरी छवि) है, जिसमें एक प्रोटॉन और एक इलेक्ट्रॉन होता है। प्रोटॉन परमाणु के केंद्र में अपने नाभिक के रूप में तैनात होता है, जबकि इलेक्ट्रॉन आसपास के स्थान की परिक्रमा करता है, जिससे कम इलेक्ट्रॉन घनत्व वाले क्षेत्रों को छोड़ देता है क्योंकि यह नाभिक से दूर चला जाता है.
यह एक तटस्थ परमाणु है क्योंकि यह सच है कि Z इलेक्ट्रॉनों की संख्या (1p = 1e) के बराबर है। यदि H परमाणु उस एकल प्रोटॉन को खो देता है, तो परमाणु त्रिज्या सिकुड़ जाएगी और H cation बनकर प्रोटॉन चार्ज प्रबल हो जाएगा।+ (Hydron)। अगर, दूसरी ओर, यह एक इलेक्ट्रॉन प्राप्त करता है, तो दो इलेक्ट्रॉन होंगे और यह एच आयन होगा-- (Hydride).
सूची
- 1 तटस्थ परमाणु बनाम आयन
- १.१ ना बनाम ना+
- 2 तटस्थ अणु
- 3 उदाहरण
- 3.1 ऑक्सीजन
- 3.2 कॉपर
- 3.3 महान गैसें
- ३.४ धातु मिश्र
- 4 संदर्भ
तटस्थ परमाणु बनाम आयन
एच के तटस्थ परमाणु के उदाहरण के लिए, यह पाया गया कि प्रोटॉन की संख्या इलेक्ट्रॉनों की संख्या के बराबर होती है (1p = 1e); ऐसी स्थिति जो व्युत्पन्न आयनों के साथ नहीं होती है एक इलेक्ट्रॉन की हानि या लाभ.
आयन इलेक्ट्रॉनों की संख्या में परिवर्तन से बनते हैं, या तो क्योंकि परमाणु उन्हें जीतता है (-) या उन्हें खो देता है (+).
कटनी के परमाणु में एच+ इलेक्ट्रॉन की कुल अनुपस्थिति (1p> 0e) के सामने एकान्त प्रोटॉन का वैलेंस चार्ज प्रबल होता है। यह आवर्त सारणी के अन्य सभी भारी परमाणुओं (np> ne) के लिए सही है.
हालांकि एक सकारात्मक चार्ज की उपस्थिति महत्वहीन लग सकती है, यह प्रश्न में तत्व की विशेषताओं को तिरछे बदल देता है.
दूसरी ओर, आयनों परमाणु में एच- दो इलेक्ट्रॉनों का ऋणात्मक आवेश एकल कोर प्रोटॉन (1p) के सामने प्रबल होता है<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
ना बनाम ना+
एक बेहतर ज्ञात उदाहरण धात्विक सोडियम है। इसका तटस्थ परमाणु, Na, Z = 11 के साथ, 11 प्रोटॉन हैं; इसलिए, सकारात्मक आरोपों की भरपाई के लिए 11 इलेक्ट्रॉन होने चाहिए (11p = 11e).
सोडियम, एक धातु तत्व होने के नाते, अत्यधिक इलेक्ट्रोपोसिटिव, बहुत आसानी से अपने इलेक्ट्रॉनों को खो देता है; इस मामले में, वह केवल एक खो देता है, जो कि उसकी वैलेंस शेल (11p> 10e) है। इस प्रकार, Na cation बनता है+, जो आयनों के साथ विद्युत रूप से संपर्क करता है; क्लोराइड की तरह, सीएल-, नमक में सोडियम क्लोराइड, NaCl.
धात्विक सोडियम जहरीला और संक्षारक होता है, जबकि इसका केशन कोशिकाओं के अंदर भी मौजूद होता है। इससे पता चलता है कि किसी तत्व के गुण इलेक्ट्रॉनिक रूप से बढ़ने या खो देने पर कैसे भिन्न हो सकते हैं.
दूसरी ओर, ना आयन- (soduro, hypothetically) मौजूद नहीं है; और बनाने में सक्षम होने के लिए, यह अत्यंत प्रतिक्रियाशील होगा, क्योंकि यह इलेक्ट्रॉनों को प्राप्त करने के लिए सोडियम की रासायनिक प्रकृति के खिलाफ है। ना- इसके नाभिक के सकारात्मक चार्ज (11p) को पार करते हुए, 12 इलेक्ट्रॉन होंगे<12e).
तटस्थ अणु
अणुओं को जन्म देने के लिए परमाणुओं को सहसंयोजक रूप से जोड़ा जाता है, जिसे यौगिक भी कहा जा सकता है। एक अणु के भीतर कोई पृथक आयन नहीं हो सकते; इसके बजाय, सकारात्मक या नकारात्मक औपचारिक शुल्क वाले परमाणु हैं। ये आवेशित परमाणु अणु के शुद्ध आवेश को प्रभावित करते हैं, इसे एक पॉलीऐटोमिक आयन में बदलते हैं.
अणु के तटस्थ होने के लिए, उसके परमाणुओं के औपचारिक आवेशों का योग शून्य के बराबर होना चाहिए; या, अधिक सरलता से, इसके सभी परमाणु तटस्थ हैं। यदि अणु बनाने वाले परमाणु तटस्थ हैं, तो यह भी होगा.
उदाहरण के लिए, आपके पास पानी का अणु, एच2O. इसके दो H परमाणु ऑक्सीजन परमाणु की तरह ही तटस्थ हैं। उन्हें उसी तरह से प्रतिनिधित्व नहीं किया जा सकता है जैसा कि हाइड्रोजन परमाणु की छवि में दिखाया गया है; चूंकि, कोर नहीं बदलता है, इलेक्ट्रॉनिक क्लाउड करता है.
हाइड्रोनियम आयन, एच3हे+, दूसरी ओर, इसमें आंशिक सकारात्मक चार्ज के साथ ऑक्सीजन परमाणु होता है। इसका मतलब यह है कि उस पॉलीऐटोमिक आयन में यह एक इलेक्ट्रॉन खो देता है, और इसलिए इसके प्रोटॉन की संख्या इसके इलेक्ट्रॉनों की तुलना में अधिक होती है.
उदाहरण
ऑक्सीजन
तटस्थ ऑक्सीजन परमाणु में 8 प्रोटॉन और 8 इलेक्ट्रॉन होते हैं। जब यह दो इलेक्ट्रॉनों को प्राप्त करता है, तो यह बनता है जिसे आयन ऑक्साइड, या के रूप में जाना जाता है2-. इसमें, दो इलेक्ट्रॉनों (8p) की अधिकता वाले नकारात्मक चार्ज की भविष्यवाणी की जाती है<10e).
तटस्थ ऑक्सीजन परमाणुओं में प्रतिक्रिया करने और ओ बनाने के लिए खुद को बांधने की उच्च प्रवृत्ति होती है2. यह इस कारण से है कि उनके भाग्य में कोई परमाणु या "ढीले" नहीं हैं और बिना किसी प्रतिक्रिया के। इस गैस के लिए सभी ज्ञात प्रतिक्रियाओं को आणविक ऑक्सीजन, या के लिए जिम्मेदार ठहराया जाता है2.
तांबा
कॉपर में 29 प्रोटॉन और 29 इलेक्ट्रॉन (न्यूट्रॉन के अलावा) हैं। ऑक्सीजन के विपरीत, इसके तटस्थ परमाणुओं को उनके धातु बंधन और सापेक्ष स्थिरता के कारण प्रकृति में पाया जा सकता है.
सोडियम की तरह, यह उन्हें जीतने के बजाय इलेक्ट्रॉनों को खो देता है। इसके इलेक्ट्रॉनिक कॉन्फ़िगरेशन और अन्य पहलुओं को देखते हुए, यह एक या दो इलेक्ट्रॉनों को खो सकता है, जो कप के आकार के होते हैं, Cu+, या cupric, घन2+, क्रमश:.
Cu cation+ एक कम इलेक्ट्रॉन (29 पी) है<28e), y el Cu2+ दो इलेक्ट्रॉनों (29p) को खो दिया है<27e).
कुलीन गैसें
कुलीन गैसें (वह, ने, अर, क्र, क्ष, रं), उन कुछ तत्वों में से एक हैं जो अपने उदासीन परमाणुओं के रूप में मौजूद हैं। उनकी परमाणु संख्याएँ क्रमश: 2, 10, 18, 36, 54 और 86 हैं। वे इलेक्ट्रॉनों को हासिल या खो नहींते हैं; हालांकि, क्सीनन, एक्सई, फ्लोरीन के साथ यौगिक बना सकते हैं और इलेक्ट्रॉनों को खो सकते हैं.
धातु मिश्र धातु
धातु, अगर जंग से संरक्षित होती है, तो धातु के बंधन से जुड़े अपने तटस्थ परमाणुओं को रख सकते हैं। धातुओं में, धातुओं के ठोस समाधान, परमाणु (अधिकतर) तटस्थ रहते हैं। उदाहरण के लिए, पीतल में, Cu और Zn के उदासीन परमाणु होते हैं.
संदर्भ
- जेटसर कैरास्को। (2016)। एक तटस्थ परमाणु क्या है? से लिया गया: परिचय-to-physics.com
- अंकन, शमूएल। (25 अप्रैल, 2017)। गैर-तटस्थ परमाणु उदाहरण। Sciencing। से लिया गया: Sciencing.com
- Chem4Kids। (2018)। आयनों को देखना। से लिया गया: chem4kids.com
- Whitten, डेविस, पेक और स्टेनली। (2008)। रसायन विज्ञान। (8 वां संस्करण।) CENGAGE लर्निंग.
- कंपकंपी और एटकिंस। (2008)। अकार्बनिक रसायन (चौथा संस्करण)। मैक ग्रे हिल.


