बॉयल-मैरियट इतिहास का कानून, गणितीय अभिव्यक्ति, उदाहरण
का कानून बॉयल वह है जो गैस पर या उसके द्वारा डाले गए दबाव और उस पर व्याप्त आयतन के बीच के संबंध को व्यक्त करता है; गैस के तापमान को स्थिर रखना, साथ ही इसकी मात्रा (मोल्स की संख्या).
यह कानून, चार्ल्स, गे-लुसाक, चार्ल्स और एवोगाद्रो के साथ मिलकर एक आदर्श गैस के व्यवहार का वर्णन करता है; विशेष रूप से, यांत्रिक बल द्वारा मात्रा में परिवर्तन के अधीन एक बंद कंटेनर में.
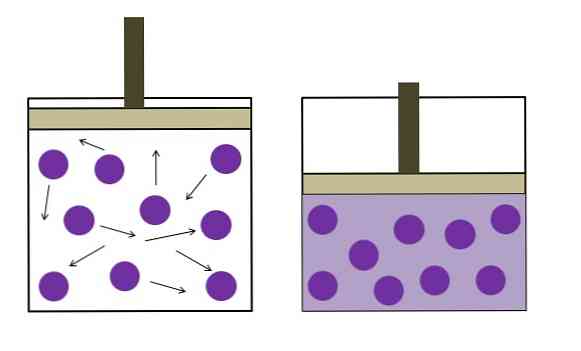
ऊपर की छवि संक्षेप में बॉयल-मारियोटे कानून का सार प्रस्तुत करती है.
बैंगनी डॉट्स अणुओं या गैस परमाणुओं का प्रतिनिधित्व करते हैं, जो कंटेनर (बाएं) की आंतरिक दीवारों से टकराते हैं। इस गैस के कब्जे वाले कंटेनर की उपलब्ध जगह या मात्रा को कम करके, टकराव बढ़ता है, जो दबाव (दाएं) में वृद्धि में बदल जाता है.
इससे पता चलता है कि अगर गैस को सीमांकित रूप से सील कर दिया जाता है तो गैस का दबाव P और आयतन V व्युत्क्रमानुपाती होता है; अन्यथा, एक उच्च दबाव कंटेनर के अधिक से अधिक विस्तार के बराबर होगा.
यदि क्रमशः Y और X कुल्हाड़ियों पर V और P के डेटा के साथ P के खिलाफ एक प्लॉट V बनाया जाता है, तो एक स्पर्शोन्मुख वक्र देखा जाएगा। छोटा V है, P में जितनी अधिक वृद्धि होगी; अर्थात, X अक्ष पर P उच्च मानों तक फैलेगा.
बेशक, तापमान स्थिर रहता है; लेकिन, यदि एक ही प्रयोग अलग-अलग तापमान पर किया जाता है, तो इन वक्रों V बनाम P की सापेक्ष स्थिति कार्टेशियन अक्ष में बदल जाएगी। यदि यह Z अक्ष पर स्थिर T के साथ त्रि-आयामी धुरी पर स्थित हो तो परिवर्तन और भी स्पष्ट होगा.
सूची
- 1 बॉयल के नियम का इतिहास
- १.१ पृष्ठभूमि
- 1.2 पारे के साथ प्रयोग
- 1.3 एदमे मारियट्टे
- १.४ कानून को मजबूत बनाना
- 2 इस कानून में क्या है??
- 3 गणितीय अभिव्यक्ति
- 4 यह किस लिए है? बॉयल के नियम से क्या समस्याएं हल होती हैं??
- 4.1 स्टीम मशीन
- ४.२ सिप पीता है
- 4.3 श्वसन प्रणाली
- 5 उदाहरण (प्रयोग)
- ५.१ प्रयोग १
- ५.२ प्रयोग २
- 6 संदर्भ
बॉयल के नियम का इतिहास
पृष्ठभूमि
चूंकि वैज्ञानिक गैलीलियो गैलीली ने शून्यता (1638) के अस्तित्व में विश्वास व्यक्त किया, इसलिए वैज्ञानिकों ने हवा और आंशिक voids के गुणों का अध्ययन करना शुरू कर दिया।.
एंग्लो-आयरिश केमिस्ट, रॉबर्ट बॉयल, ने 1638 में वायु गुणों के बारे में अध्ययन शुरू किया, यह जानने के लिए कि जर्मन इंजीनियर और भौतिक विज्ञानी ओटो वॉन गुएरिक ने एक एयर पंप बनाया था.
पारे के साथ प्रयोग
वायु दबाव के अपने अध्ययन को करने के लिए, बॉयल ने "जे" के आकार में एक ग्लास ट्यूब का उपयोग किया, जिसके निर्माण का श्रेय बॉयल के सहायक रॉबर्ट हूक को दिया गया। शॉर्ट आर्म के अंत को सील कर दिया गया था, जबकि ट्यूब के लंबे हाथ का अंत पारा लगाने के लिए खुला था.
शुरुआत से, बॉयल ने हवा की लोच, गुणात्मक और मात्रात्मक रूप से अध्ययन करना चाहा। "जे" आकार की ट्यूब के खुले अंत के माध्यम से पारा डालकर, बॉयल ने कटौती की कि ट्यूब के शॉर्ट आर्म में हवा पारा दबाव के तहत सिकुड़ती है.
परिणाम
ट्यूब में पारे की मात्रा जितनी अधिक होगी, हवा पर दबाव उतना ही अधिक होगा और इसकी मात्रा कम होगी। बॉयल ने दबाव के एक समारोह के रूप में हवा की मात्रा का एक नकारात्मक घातीय प्रकार ग्राफ प्राप्त किया.
हालांकि, यदि आप दबाव के विपरीत हवा की मात्रा को प्लॉट करते हैं, तो आपके पास सकारात्मक ढलान की एक सीधी रेखा है.
1662 में, बॉयल ने पहला शारीरिक कानून प्रकाशित किया जो एक समीकरण के रूप में दिया गया था, जिसने दो चर की कार्यात्मक निर्भरता का संकेत दिया था। इस मामले में, दबाव और मात्रा.
बॉयल ने बताया कि एक गैस पर दबाव और उस गैस द्वारा ग्रहण की गई मात्रा के बीच उलटा संबंध था, यह अनुपात वास्तविक गैसों के लिए अपेक्षाकृत सही है। अधिकांश गैसें मध्यम दबाव और तापमान पर आदर्श गैसों की तरह व्यवहार करती हैं.
उच्च दबाव और कम तापमान के साथ, आदर्शों की वास्तविक गैसों के व्यवहार से विचलन अधिक ध्यान देने योग्य हो गए.
एडमे मारियट
फ्रांसीसी भौतिक विज्ञानी एडमे मारियोटे (1620-1684) ने स्वतंत्र रूप से 1679 में एक ही कानून की खोज की। लेकिन इसमें यह दिखाने का गुण था कि मात्रा तापमान के साथ बदलती रहती है। इसलिए इसे मारियट का नियम या बॉयल का और मारियट का नियम कहा जाता है.
कानून को मजबूत बनाना
डैनियल बर्नौली (1737) ने बॉयल के नियम को मजबूत करते हुए कहा कि एक गैस का दबाव कंटेनर की दीवारों पर गैस कणों के प्रभाव से उत्पन्न होता है।.
1845 में, जॉन वॉटरस्टन ने एक वैज्ञानिक लेख प्रकाशित किया, जिसमें वह गैसों के गतिज सिद्धांत के मुख्य सिद्धांतों पर ध्यान केंद्रित करते हैं.
बाद में, रुडोल्फ क्लॉज़ियस, जेम्स मैक्सवेल और लुडकविग बोल्टज़मैन ने गैसों के गतिज सिद्धांत को समेकित किया, जो गैस द्वारा गति में गैस के कणों के वेग से उत्पन्न दबाव से संबंधित है।.
गैस युक्त कंटेनर की मात्रा जितनी कम होगी, कंटेनर की दीवारों के खिलाफ इसे बनाने वाले कणों के प्रभावों की आवृत्ति जितनी अधिक होगी; और इसलिए, गैस द्वारा अधिक से अधिक दबाव डाला गया.
इस कानून में क्या शामिल है??
बॉयल द्वारा किए गए प्रयोगों से पता चलता है कि गैस द्वारा घेरे गए आयतन और उस पर दबाव डाले जाने के बीच उलटा संबंध है। हालाँकि, उपरोक्त संबंध पूरी तरह से रैखिक नहीं है, जैसा कि बॉयल के दबाव के अनुसार आयतन भिन्नता के ग्राफ से संकेत मिलता है।.
बॉयल के नियम में यह इंगित किया गया है कि एक गैस द्वारा कब्जा की गई मात्रा दबाव के विपरीत आनुपातिक है। यह भी संकेत दिया गया है कि इसकी मात्रा से गैस के दबाव का उत्पाद स्थिर है.
गणितीय अभिव्यक्ति
बॉयल-मारियोटे कानून की गणितीय अभिव्यक्ति के लिए, हम निम्न से शुरू करते हैं:
वी α 1 / पी
जहाँ यह इंगित करता है कि गैस द्वारा ग्रहण किया गया आयतन इसके दबाव के व्युत्क्रमानुपाती होता है। हालांकि, एक निरंतरता है जो यह बताती है कि यह संबंध कितना आनुपातिक है.
वी = के / पी
जहाँ k आनुपातिकता का स्थिरांक है। आपके पास क्लियरिंग k:
वीपी = के
किसी गैस के आयतन के दबाव का गुणनफल स्थिर होता है। तो:
वी1पी1 = के और वी2पी2 = के
और इससे यह काटा जा सकता है कि:
वी1पी1 = वी2पी2
उत्तरार्द्ध बॉयल के नियम के लिए अंतिम अभिव्यक्ति या समीकरण है.
इसके लिए क्या है? बॉयल के नियम से क्या समस्याएं हल होती हैं??
भाप की मशीनें

बॉयल-मैरियट का कानून भाप इंजन के संचालन पर लागू होता है। यह एक बाहरी दहन इंजन है जो पानी की मात्रा से यांत्रिक ऊर्जा में थर्मल ऊर्जा के परिवर्तन का उपयोग करता है.
पानी को गर्म रूप से सील किए गए बॉयलर में गर्म किया जाता है, और स्टीम का उत्पादन बॉयल-मिरोटे कानून के अनुसार एक दबाव बनाता है जो एक पिस्टन को धक्का देकर सिलेंडर के वॉल्यूम विस्तार का उत्पादन करता है.
पिस्टन के रैखिक आंदोलन को क्रैंक और क्रैंक की एक प्रणाली के उपयोग के माध्यम से एक घूर्णी आंदोलन में बदल दिया जाता है, जो एक लोकोमोटिव या इलेक्ट्रिक जनरेटर के रोटर को ड्राइव कर सकता है.
वर्तमान में, वैकल्पिक स्टीम इंजन थोड़ा इस्तेमाल किया जाने वाला इंजन है, क्योंकि यह इलेक्ट्रिक मोटर और परिवहन वाहनों में आंतरिक दहन इंजन द्वारा विस्थापित किया गया है.
शराब पीना
प्लास्टिक ट्यूब के माध्यम से एक बोतल से शीतल पेय या रस चूसने की क्रिया बॉयल-मारियोटे कानून से संबंधित है। जब ट्यूब को मुंह का उपयोग करके हवा से चूसा जाता है, तो ट्यूब के अंदर दबाव में कमी होती है.
यह दबाव ड्रॉप ट्यूब में तरल के ऊपर की ओर की सुविधा की सुविधा देता है, जिससे इसकी अंतर्ग्रहण की अनुमति मिलती है। यह एक ही सिद्धांत सिरिंज का उपयोग करके रक्त के निष्कर्षण में काम करता है.
श्वसन प्रणाली
बॉयल-मैरियट का नियम श्वसन प्रणाली के कामकाज से संबंधित है। प्रेरणा चरण के दौरान, डायाफ्राम और अन्य मांसपेशियों का संकुचन होता है; उदाहरण के लिए, बाहरी इंटरकोस्टल जो रिब पिंजरे के विस्तार का उत्पादन करते हैं.
यह अंतःस्रावी दबाव में कमी का कारण बनता है, जो फेफड़ों के विस्तार का कारण बनता है जो फेफड़ों की मात्रा में वृद्धि पैदा करता है। इसलिए, बॉयल-मैरियट कानून में जो कहा गया है, उसके अनुसार अंतर-दबाव का दबाव कम हो जाता है.
जब इंट्रापल्मोनरी दबाव उप वायुमंडलीय होता है, तो वायुमंडलीय हवा फेफड़ों में प्रवाहित होती है, जिसके परिणामस्वरूप फेफड़ों में दबाव बढ़ जाता है; बराबर, वायुमंडलीय दबाव के लिए इसका दबाव, और प्रेरणा के चरण का समापन.
इसके बाद, श्वसन की मांसपेशियां शिथिल हो जाती हैं और श्वसन की मांसपेशियां सिकुड़ जाती हैं। इसके अलावा, फुफ्फुसीय लोचदार प्रत्यावर्तन होता है, एक घटना जो फेफड़ों की मात्रा में कमी पैदा करती है, जिसके परिणामस्वरूप इंट्रापल्मोनरी दबाव में वृद्धि होती है, जिसे बॉयल-मारियोटे कानून द्वारा समझाया जा सकता है।.
इंट्रापल्मोनरी प्रेशर बढ़ने और वायुमंडलीय दबाव से अधिक होने से, वायु फेफड़ों से वायुमंडल में प्रवाहित होती है। यह तब तक होता है जब तक कि दबाव बराबर नहीं हो जाते हैं, जो समाप्ति चरण का समापन करता है.
उदाहरण (प्रयोग)
प्रयोग १
एक छोटे से गुब्बारे को कसकर बंद कर दिया जाता है, जिससे उसके मुंह में एक गाँठ बन जाती है, एक सिरिंज के अंदर, जिसमें सवार को हटा दिया गया है, लगभग 20 मिलीलीटर। सिरिंज के सवार को सिरिंज के मध्य भाग की ओर रखा जाता है, सुई को हटा दिया जाता है और हवा के प्रवेश को बाधित किया जाता है.
अवलोकन
इंजेक्टर के प्लंजर को धीरे-धीरे खींचकर, यह देखा जाता है कि गुब्बारा फुलाया जाता है.
व्याख्या
गुब्बारे की दीवार पर दो दबाव डाले जाते हैं: उसके आंतरिक चेहरे पर एक दबाव, गुब्बारे के अंदर मौजूद हवा का उत्पाद, और गुब्बारे के बाहरी चेहरे पर एक और दबाव, सिरिंज में निहित हवा द्वारा बाहर निकाला गया.
इंजेक्टर के प्लंजर को खींचते समय, इसके अंदर एक आधा-वैक्यूम बनाया जाता है। इसलिए, पंप की दीवार के बाहरी चेहरे पर हवा का दबाव कम हो जाता है, जिससे पंप के अंदर दबाव अपेक्षाकृत अधिक बढ़ जाता है।.
बॉयल-मैरियट कानून के अनुसार, यह शुद्ध दबाव, गुब्बारा दीवार की दूरी और गुब्बारे की मात्रा में वृद्धि का उत्पादन करेगा।.
प्रयोग २
प्लास्टिक की बोतल को काटें, लगभग आधा, यह सुनिश्चित करते हुए कि कटौती यथासंभव क्षैतिज है। बोतल के मुंह में एक अच्छी तरह से समायोजित गुब्बारा रखा जाता है, उसी समय एक गहरी डिश में पानी की एक निश्चित मात्रा रखी जाती है.
अवलोकन
डिश के पानी पर गुब्बारे के साथ बोतल के नीचे रखकर, गुब्बारे को मामूली फुलाया जाता है.
व्याख्या
पानी हवा की एक निश्चित मात्रा को विस्थापित करता है, जिससे बोतल की दीवार और गुब्बारे के अंदरूनी हिस्से पर हवा का दबाव बढ़ जाता है। यह बॉयल-मैरियट के कानून के अनुसार होता है, विश्व की मात्रा में वृद्धि, जो कि विश्व की मुद्रास्फीति द्वारा कल्पना की जाती है.
संदर्भ
- विकिपीडिया। (2019)। बॉयल का नियम। से लिया गया: en.wikipedia.org
- एनसाइक्लोपीडिया ब्रिटानिका के संपादक। (27 जुलाई, 2018)। बॉयल का नियम। एनसाइक्लोपीडिया ब्रिटानिका। से लिया गया: britannica.com
- हेल्मेनस्टाइन, टॉड। (५ दिसंबर २०१8)। बॉयल के नियम के लिए सूत्र। से लिया गया: सोचाco.com
- युवा भारतीय फिल्में। (15 मई, 2018)। बॉयल का नियम: बच्चों के लिए विज्ञान प्रयोग। से लिया गया: yifindia.com
- सेसिलिया बेमिब्रे (22 मई, 2011)। गर्म हवा का गुब्बारा परिभाषा एबीसी। से लिया गया: definicionabc.com
- गोनॉन्ग, डब्ल्यू, एफ (2003)। मेडिकल फिजियोलॉजी (19 वां संस्करण)। संपादकीय द मॉडर्न मैनुअल.


