आणविक ज्यामिति प्रकार और उदाहरण
आणविक ज्यामिति या आणविक संरचना एक केंद्रीय परमाणु के चारों ओर परमाणुओं का स्थानिक वितरण है। परमाणु उन क्षेत्रों का प्रतिनिधित्व करते हैं जहां एक उच्च इलेक्ट्रॉनिक घनत्व है, और इसलिए इलेक्ट्रॉनिक समूहों पर विचार किया जाता है, चाहे वे लिंक के रूप में हों (एकल, डबल या ट्रिपल).
यह अवधारणा दो सिद्धांतों के संयोजन और प्रयोगात्मक डेटा से पैदा हुई है: वैलेंस बॉन्ड (TEV) और वैलेंस शेल (VSPR) के इलेक्ट्रॉनिक जोड़े के प्रतिकर्षण। जबकि पहला लिंक और उनके कोणों को परिभाषित करता है, दूसरा ज्यामिति को स्थापित करता है और इसलिए, आणविक संरचना.

क्या ज्यामितीय आकार अणु अपनाने में सक्षम हैं? पिछले दो सिद्धांत उत्तर प्रदान करते हैं। वीएसईपीआर के अनुसार, मुक्त इलेक्ट्रॉनों के परमाणुओं और जोड़े को अंतरिक्ष में इस तरह से व्यवस्थित किया जाना चाहिए, ताकि उनके बीच इलेक्ट्रोस्टैटिक प्रतिकर्षण कम हो सके।.
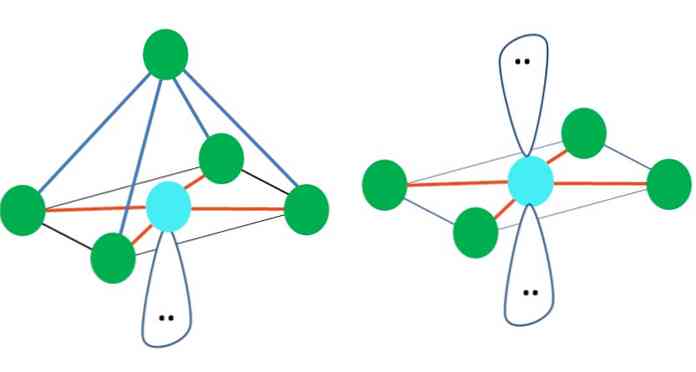
तो, ज्यामितीय आकृतियाँ मनमानी नहीं हैं, लेकिन सबसे स्थिर डिजाइन की तलाश करें। उदाहरण के लिए, ऊपरी छवि में एक त्रिकोण बाईं ओर और एक ऑक्टाहेड्रन को दाईं ओर देखा जा सकता है। हरे डॉट्स परमाणुओं का प्रतिनिधित्व करते हैं और नारंगी लिंक को धारित करते हैं.
त्रिभुज में, तीन हरे बिंदु 120º के पृथक्करण में उन्मुख होते हैं। यह कोण, जो कि बंधन के बराबर है, परमाणुओं को एक-दूसरे को जितना संभव हो उतना पीछे हटाने की अनुमति देता है। इसलिए, तीन अन्य से जुड़े एक केंद्रीय परमाणु के साथ एक अणु एक त्रिकोणीय विमान ज्यामिति को अपनाएगा.
हालांकि, वीएससीआर भविष्यवाणी करता है कि केंद्रीय परमाणु में इलेक्ट्रॉनों की एक नि: शुल्क जोड़ी ज्यामिति को विकृत करेगी। त्रिकोणीय विमान के मामले के लिए, यह जोड़ी तीन हरे बिंदुओं को नीचे धकेल देगी, जिसके परिणामस्वरूप एक त्रिकोण पिरामिड ज्यामिति होगा.
ऐसा ही छवि के ऑक्टाहेड्रॉन के साथ भी हो सकता है। इसमें सभी परमाणुओं को सबसे स्थिर तरीके से अलग किया जाता है.
सूची
- 1 एक परमाणु एक्स के आणविक ज्यामिति के बारे में पहले से कैसे पता करें?
- 2 प्रकार
- २.१ अलंकार
- २.२ कोणीय
- 2.3 टेट्राहेड्रल
- २.४ ट्राइजोनल बिपिरिमिड
- 2.5 ऑक्टाहेड्रल
- 2.6 अन्य आणविक ज्यामितीय
- 3 उदाहरण
- 3.1 रेखीय ज्यामिति
- 3.2 कोणीय ज्यामिति
- ३.३ त्रिगुट योजना
- 3.4 टेट्राहेड्रल
- 3.5 ट्राइजोनल पिरामिड
- 3.6 त्रिकपर्दी द्विभाजम
- ३.३ ओषधि
- 3.8 टी का आकार
- 3.9 अष्टाध्यायी
- 4 संदर्भ
एक परमाणु एक्स के आणविक ज्यामिति को अग्रिम में कैसे पता चलेगा?
इसके लिए, मुक्त इलेक्ट्रॉनों के जोड़े को इलेक्ट्रॉनिक समूह के रूप में मानना भी आवश्यक है। ये, परमाणुओं के साथ मिलकर परिभाषित करेंगे कि किस नाम से जाना जाता है इलेक्ट्रॉनिक ज्यामिति, जो आणविक ज्यामिति का एक अविभाज्य साथी है.
इलेक्ट्रॉनिक ज्यामिति से, और लुईस संरचना द्वारा मुक्त इलेक्ट्रॉनों के जोड़े का पता लगाने से, हम यह निर्धारित कर सकते हैं कि आणविक ज्यामिति क्या होगी। सभी आणविक ज्यामिति का योग वैश्विक संरचना की रूपरेखा प्रदान करेगा.
टाइप
जैसा कि मुख्य छवि में देखा जाता है, आणविक ज्यामिति इस बात पर निर्भर करती है कि कितने परमाणु केंद्रीय परमाणु को घेरे हुए हैं। हालांकि, यदि इलेक्ट्रॉनों की एक जोड़ी बिना साझा किए मौजूद है, तो यह ज्यामिति को संशोधित करेगा क्योंकि यह बहुत अधिक मात्रा में है। इसलिए, यह एक स्थैतिक प्रभाव डालती है.
इसके अनुसार, ज्यामिति कई अणुओं के लिए विशेषता आकृतियों की एक श्रृंखला प्रस्तुत कर सकती है। और यह वह जगह है जहाँ विभिन्न प्रकार की आणविक ज्यामिति या आणविक संरचना उत्पन्न होती है.
ज्यामिति संरचना के बराबर कब होती है? दोनों केवल उन मामलों में ही निरूपित करते हैं जहां संरचना में एक से अधिक प्रकार की ज्यामिति नहीं होती है; अन्यथा, सभी वर्तमान प्रकारों पर विचार किया जाना चाहिए और संरचना को एक वैश्विक नाम (रैखिक, शाखित, गोलाकार, सपाट, आदि) दिया गया है।.
ज्यामितीय इसकी संरचनात्मक इकाइयों से एक ठोस की संरचना की व्याख्या करने के लिए विशेष रूप से उपयोगी हैं.
रैखिक
सभी सहसंयोजक बांड दिशात्मक हैं, इसलिए लिंक ए-बी रैखिक है। लेकिन क्या एबी अणु रैखिक होगा?2? यदि हाँ, तो ज्यामिति को केवल B- A-B के रूप में दर्शाया जाता है। दो बी परमाणुओं को 180 ° के कोण से अलग किया जाता है, और TEV के अनुसार, A में हाइब्रिड ऑर्बिटल्स होने चाहिए.
कोणीय
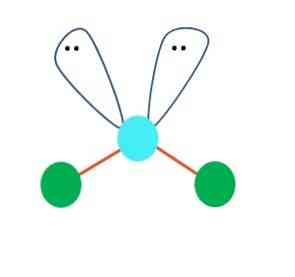
यह पहली बार एबी अणु के लिए एक रेखीय ज्यामिति माना जा सकता है2; हालांकि, निष्कर्ष पर पहुंचने से पहले लुईस की संरचना को तैयार करना आवश्यक है। लुईस की संरचना को आकर्षित करते हुए, कोई भी साझा करने के बिना इलेक्ट्रॉनों के जोड़े की संख्या की पहचान कर सकता है (:) ए के परमाणु पर.
जब ऐसा होता है, तो इलेक्ट्रॉन जोड़े के ऊपर वे बी के दो परमाणुओं को धक्का देते हैं, जिससे उनके कोण बदल जाते हैं। नतीजतन, रैखिक अणु B-A-B एक V, बूमरैंग या कोणीय ज्यामिति (शीर्ष छवि) बन कर समाप्त हो जाता है
पानी के अणु, एच-ओ-एच, इस प्रकार की ज्यामिति के लिए आदर्श उदाहरण है। ऑक्सीजन परमाणु में इलेक्ट्रॉनों के दो जोड़े होते हैं जिन्हें साझा किए बिना 109º के अनुमानित कोण पर उन्मुख किया जाता है.
यह कोण क्यों? क्योंकि इलेक्ट्रॉनिक ज्यामिति टेट्राहेड्रल है, जिसमें चार कोने हैं: H परमाणुओं के लिए दो और इलेक्ट्रॉनों के लिए दो। ऊपर की छवि में ध्यान दें कि हरे रंग के डॉट्स और दो "आंखों के साथ लोब" अपने केंद्र में नीले रंग के बिंदु के साथ एक टेट्राहेड्रॉन खींचते हैं.
यदि ओ में कोई मुक्त इलेक्ट्रॉन जोड़े नहीं थे, तो पानी एक रैखिक अणु का निर्माण करेगा, इसकी ध्रुवीयता कम हो जाएगी और महासागरों, समुद्रों, झीलों, आदि का अस्तित्व नहीं रहेगा, क्योंकि वे ज्ञात हैं.
चतुष्फलकीय
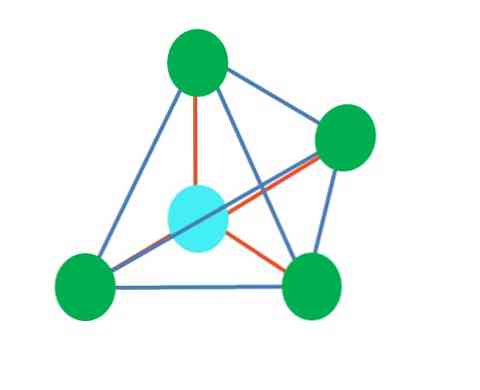
ऊपरी छवि टेट्राहेड्रल ज्यामिति का प्रतिनिधित्व करती है। पानी के अणु के लिए, इसका इलेक्ट्रॉनिक ज्यामिति टेट्राहेड्रल है, लेकिन इलेक्ट्रॉन मुक्त जोड़े को हटाकर यह देखा जा सकता है कि यह कोणीय ज्यामिति में बदल जाता है। यह भी केवल दो हरे डॉट्स को समाप्त करके मनाया जाता है; शेष दो नीली बिंदी के साथ V खींचेंगे.
क्या होगा अगर दो जोड़े मुक्त इलेक्ट्रॉनों के बजाय केवल एक ही था? फिर एक त्रिकोणीय विमान (मुख्य छवि) होगा। हालांकि, एक इलेक्ट्रॉनिक समूह को समाप्त करने से, मुक्त इलेक्ट्रॉनों की जोड़ी द्वारा उत्पन्न स्टिकरी प्रभाव से बचा नहीं जाता है। इसलिए, यह त्रिकोणीय विमान को त्रिकोणीय आधार पिरामिड में विकृत करता है:

यद्यपि त्रिकोणीय और टेट्राहेड्रल पिरामिड आणविक ज्यामिति अलग हैं, इलेक्ट्रॉनिक ज्यामिति समान है: टेट्राहेड्रल। तो ट्राइजोनल पिरामिड इलेक्ट्रॉनिक ज्यामिति के रूप में नहीं गिना जाता है?
इसका उत्तर नहीं है, क्योंकि यह "आंखों के साथ लोब" और उसके स्थैतिक प्रभाव के कारण विकृति का एक उत्पाद है, और यह ज्यामिति बाद में विकृतियों को ध्यान में नहीं रखता है।.
इस कारण से, आणविक ज्यामिति को परिभाषित करने से पहले लुईस संरचनाओं की मदद से इलेक्ट्रॉनिक ज्यामिति का निर्धारण करना हमेशा महत्वपूर्ण होता है। अमोनिया अणु, एनएच3, त्रिकोणीय पिरामिड आणविक ज्यामिति का एक उदाहरण है, लेकिन टेट्राहेड्रल इलेक्ट्रॉनिक ज्यामिति के साथ.
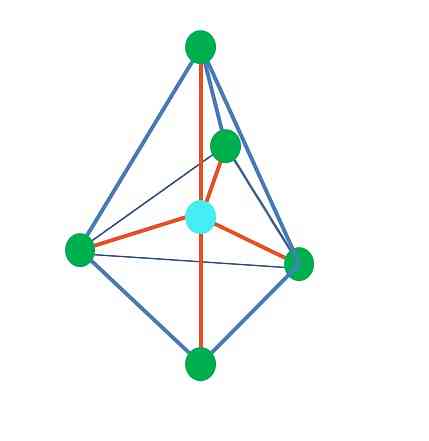
ट्राइजोनल बिपिरिमिड
अब तक, रैखिक ज्यामिति के अपवाद के साथ, टेट्राहेड्रल में, कोणीय और त्रिकोणीय पिरामिड में इसके केंद्रीय परमाणुओं में संकरण होता है।3, TEV के अनुसार। इसका मतलब है कि यदि आपके लिंक कोणों को प्रयोगात्मक रूप से निर्धारित किया गया था, तो उन्हें लगभग 109 link होना चाहिए.
त्रिकोणीय डिपिरमाइडल ज्यामिति से, केंद्रीय परमाणु के चारों ओर पांच इलेक्ट्रॉनिक समूह हैं। ऊपरी छवि में आप पांच हरे बिंदुओं के साथ देख सकते हैं; त्रिकोणीय आधार में तीन, और अक्षीय स्थिति में दो, जो पिरामिड के शीर्ष और निचले कोने हैं.
फिर ब्लू डॉट क्या संकरण है? साधारण बॉन्ड (नारंगी) बनाने के लिए इसे पांच हाइब्रिड ऑर्बिटल्स की जरूरत होती है। यह पांच एसपी ऑर्बिटल्स के माध्यम से प्राप्त किया जाता है3डी (एक कक्षीय एस, तीन पी और डी के मिश्रण का उत्पाद).
पांच इलेक्ट्रॉनिक समूहों पर विचार करते समय, ज्यामिति पहले से ही उजागर होती है, लेकिन बिना जोड़े के इलेक्ट्रॉनों के जोड़े होने पर, यह फिर से उन विकृतियों को झेलता है जो अन्य ज्यामिति उत्पन्न करती हैं। इसके अलावा, निम्नलिखित प्रश्न उठता है: क्या ये जोड़े पिरामिड में किसी भी स्थिति पर कब्जा कर सकते हैं? ये हैं: अक्षीय या भूमध्यरेखीय.
अक्षीय और विषुवतीय स्थिति
त्रिकोणीय आधार बनाने वाले हरे बिंदु भूमध्यरेखीय पदों पर हैं, जबकि दो ऊपरी और निचले छोरों पर, अक्षीय स्थिति में हैं। जहां, अधिमानतः, बिना साझा किए इलेक्ट्रॉनों की जोड़ी स्थित होगी? उस स्थिति में जो इलेक्ट्रोस्टैटिक प्रतिकर्षण और स्थैतिक प्रभाव को कम करता है.
अक्षीय स्थिति में इलेक्ट्रॉनों की जोड़ी त्रिकोणीय आधार पर लंबवत (90 on) "दबाएगी", जबकि यदि यह भूमध्यरेखीय स्थिति में होती है, तो आधार के दो शेष इलेक्ट्रॉनिक समूह 120º अलग हो जाएंगे और दोनों सिरों को 90º (इसके बजाय) में दबाएंगे तीन, आधार के साथ).
इसलिए, केंद्रीय परमाणु अधिक स्थिर आणविक ज्यामिति उत्पन्न करने के लिए अपने इलेक्ट्रॉन-मुक्त जोड़े को विषुवतीय स्थितियों में उन्मुख करने की कोशिश करेगा.
दोलन और टी आकार
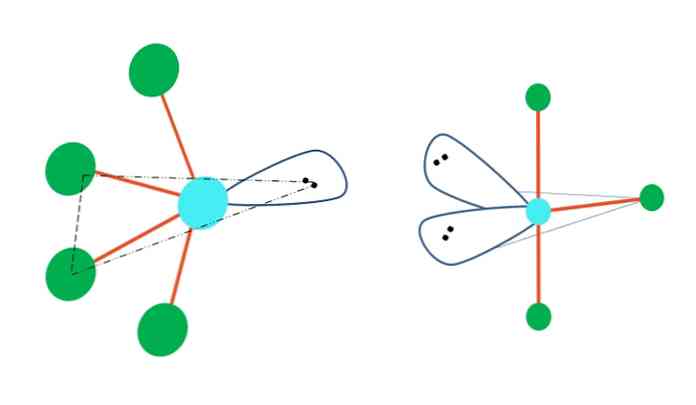
यदि त्रिपृष्ठी द्विध्रुवीय ज्यामिति इलेक्ट्रॉन मुक्त जोड़े के साथ एक या अधिक परमाणुओं को प्रतिस्थापित करने के लिए होती है, तो इसके अलग-अलग आणविक ज्यामिति भी होंगे.
शीर्ष छवि के बाईं ओर, ज्यामिति दोलन आकार में बदल जाती है। इसमें, इलेक्ट्रॉनों की मुक्त जोड़ी शेष चार परमाणुओं को एक ही दिशा में धकेलती है, उनके लिंक बाईं ओर मोड़ते हैं। ध्यान दें कि यह जोड़ी और परमाणुओं के दो मूल द्विध्रुवीय के एक ही त्रिकोणीय विमान में स्थित हैं.
और छवि के दाईं ओर, टी-आकार की ज्यामिति। यह आणविक ज्यामिति दो जोड़े इलेक्ट्रॉनों के लिए दो परमाणुओं को प्रतिस्थापित करने का परिणाम है, जिसके परिणामस्वरूप शेष तीन परमाणु एक ही विमान में संरेखित होते हैं जो बिल्कुल एक अक्षर खींचते हैं टी.
तो, प्रकार एबी के एक अणु के लिए5, यह त्रिकोणीय द्विध्रुवीय ज्यामिति को अपनाता है। हालाँकि, ए.बी.4, एक ही इलेक्ट्रॉनिक ज्यामिति के साथ, यह दोलन ज्यामिति को अपनाएगा; और ए.बी.3, T- आकार की ज्यामिति। उन सभी में A का (आमतौर पर) संकरण होगा3घ.
आणविक ज्यामिति का निर्धारण करने के लिए यह आवश्यक है कि लुईस संरचना और इसलिए इसका इलेक्ट्रॉनिक ज्यामिति। यदि यह एक त्रिकोणीय द्विध्रुवीय है, तो इलेक्ट्रॉन मुक्त जोड़े को त्याग दिया जाएगा, लेकिन बाकी परमाणुओं पर उनके स्थैतिक प्रभाव नहीं होंगे। इस प्रकार, तीन संभव आणविक ज्यामितीयों के बीच पूरी तरह से अंतर करना संभव है.
अष्टभुजाकार
ऑक्टाहेड्रल आणविक ज्यामिति को मुख्य छवि के दाईं ओर दर्शाया गया है। इस प्रकार की ज्यामिति एबी यौगिकों से मेल खाती है6. एबी4 वे वर्गाकार आधार बनाते हैं, जबकि शेष दो B अक्षीय स्थिति में स्थित होते हैं। इस प्रकार, कई समबाहु त्रिकोण बनते हैं, जो ऑक्टाहेड्रोन के चेहरे हैं.
यहां, फिर से, (सभी इलेक्ट्रॉनिक ज्यामितीयों के रूप में) मुक्त इलेक्ट्रॉन जोड़े हो सकते हैं, और इसलिए, अन्य आणविक ज्यामितीय इस तथ्य से उत्पन्न होते हैं। उदाहरण के लिए, एबी5 ऑक्टाहेड्रल इलेक्ट्रॉनिक ज्यामिति में वर्ग आधार के साथ एक पिरामिड होता है, और एबी4 एक वर्ग विमान:
ऑक्टाहेड्रल इलेक्ट्रॉनिक ज्यामिति के मामले में, इलेक्ट्रोस्टैटिक प्रतिकर्षण के संदर्भ में ये दो आणविक ज्यामिति सबसे स्थिर हैं। वर्ग-प्लानर ज्यामिति में, दो इलेक्ट्रॉन जोड़े 180 ° अलग होते हैं.
इन ज्यामितीय (या संरचनाओं में परमाणु ए के लिए संकरण क्या है, अगर यह एक ही है)? फिर से, TEV स्थापित करता है कि यह सपा है3घ2, छह हाइब्रिड ऑर्बिटल्स, जो एक ऑक्टाहेड्रोन के कोने पर इलेक्ट्रॉनिक समूहों को उन्मुख करने की अनुमति देता है.
अन्य आणविक ज्यामितीय
अब तक उल्लिखित पिरामिडों के आधारों को संशोधित करके, कुछ और जटिल आणविक ज्यामिति प्राप्त की जा सकती हैं। उदाहरण के लिए, पंचकोणीय द्विभाजक एक पंचभुज पर आधारित होता है और जो यौगिक होते हैं उनमें एक सामान्य सूत्र AB होता है7.
अन्य आणविक ज्यामितीयों की तरह, इलेक्ट्रॉन मुक्त युग्मों के लिए बी परमाणुओं का प्रतिस्थापन ज्यामिति को अन्य रूपों में विकृत कर देगा.
इसके अलावा, एबी यौगिकों8 वे वर्ग एंटीप्रिज़्म जैसे ज्यामितीय को अपना सकते हैं। कुछ ज्यामिति बहुत जटिल हो सकती हैं, खासकर एबी फॉर्मूलों के लिए7 आगे (एबी तक)12).
उदाहरण
अगला, मुख्य आणविक ज्यामिति में से प्रत्येक के लिए यौगिकों की एक श्रृंखला का उल्लेख किया जाएगा। एक अभ्यास के रूप में, आप सभी उदाहरणों के लिए लुईस संरचनाओं को आकर्षित कर सकते हैं और यह प्रमाणित कर सकते हैं कि, इलेक्ट्रॉनिक ज्यामिति को देखते हुए, आपको आणविक ज्यामिति नीचे सूचीबद्ध हैं।.
रैखिक ज्यामिति
-एथिलीन, एच2C≡CH2
-बेरिलियम क्लोराइड, BeCl2 (Cl-बी-क्लोरीन)
-कार्बन डाइऑक्साइड, CO2 (ओ = सी = ओ)
-नाइट्रोजन, एन2 (N≡N)
-बुध डाइब्रोमाइड, HgBr2 (बीआर-एचजी-बीआर)
-अनियन ट्रायोडाइड, आई3- (आई-मैं-मैं)
-हाइड्रोजन साइनाइड, HCN (H-N cC)
इसका कोण 180º होना चाहिए, और इसलिए इसका संकरण होना चाहिए.
कोणीय ज्यामिति
-पानी
-सल्फर डाइऑक्साइड, एसओ2
-नाइट्रोजन डाइऑक्साइड, सं2
-ओजोन, ओ3
-अनियन एमिडुरो, एनएच2-
त्रिगुट विमान
-ब्रोमीन ट्राइफ्लोराइड, बीएफ3
-एल्युमीनियम ट्राईक्लोराइड, AlCl3
-नाइट्रेट अनियन, सं3-
-अनियन कार्बोनेट, सीओ32-
चतुष्फलकीय
-मीथेन गैस, सीएच4
-कार्बन टेट्राक्लोराइड, CCl4
-केशन अमोनियम, एनएच4+
-अनियन सल्फेट, एसओ42-
ट्राइजोनल पिरामिड
-अमोनिया, एनएच3
-कटियन हाइड्रोनियम, एच3हे+
ट्राइजोनल बिपिरिमिड
-फास्फोरस पेंटाफ्लोराइड, पीएफ5
-एंटीमनी पेंटाक्लोराइड, एसबीएफ5
दोलन
सल्फर टेट्रफ्लुओराइड, एसएफ4
टी का आकार
-आयोडीन ट्राइक्लोराइड, आईसीएल3
-क्लोराइड ट्राइफ्लोराइड, ClF3 (दोनों यौगिकों को इंटरलॉगन्स के रूप में जाना जाता है)
अष्टभुजाकार
-सल्फर हेक्साफ्लोराइड, एसएफ6
-सेलेनियम हेक्साफ्लोराइड, सेफ़6
-हेक्साफ्लोरोफॉस्फेट, पीएफ6-
समाप्त करने के लिए, आणविक ज्यामिति वह है जो पदार्थ के रासायनिक या भौतिक गुणों का अवलोकन करती है। हालांकि, यह इलेक्ट्रॉनिक ज्यामिति के अनुसार उन्मुख है, ताकि बाद को हमेशा पहले से पहले निर्धारित किया जाना चाहिए.
संदर्भ
- Whitten, डेविस, पेक और स्टेनली। रसायन विज्ञान। (8 वां संस्करण।) CENGAGE Learning, p 194-198.
- कंपकंपी और एटकिंस। (2008)। अकार्बनिक रसायन (चौथा संस्करण।, पीपी 23, 24, 80, 169)। मैक ग्रे हिल.
- मार्क ई। टकरमैन। (2011)। आणविक ज्यामिति और VSEPR सिद्धांत। से लिया गया: nyu.edu
- वर्चुअल केमबुक, चार्ल्स ई। ओफर्डट। (2003)। आणविक ज्यामिति का परिचय। से लिया गया: केमिस्ट्री .elmhurst.edu
- रसायन शास्त्र LibreTexts। (8 सितंबर 2016)। अणु का ज्यामिति। से लिया गया: chem.libretexts.org


