प्रकृति में कार्बन जहां यह पाया जाता है और कैसे, गुण, उपयोग करता है
प्रकृति में कार्बन यह हीरे, तेल और भित्तिचित्रों, कई अन्य परिदृश्यों में पाया जा सकता है। यह रासायनिक तत्व आवधिक तालिका में छठे स्थान पर है और क्षैतिज पंक्ति या अवधि 2 और स्तंभ 14 में स्थित है। यह गैर-धातु और टेट्रावेलेंट है; यह है, आप साझा इलेक्ट्रॉनों या सहसंयोजक बांडों के 4 रासायनिक बांड स्थापित कर सकते हैं.
कार्बन पृथ्वी की पपड़ी में सबसे बड़ी बहुतायत वाला तत्व है। यह बहुतायत, कार्बनिक यौगिकों के निर्माण में इसकी अद्वितीय विविधता और पृथ्वी पर आमतौर पर पाए जाने वाले तापमान पर मैक्रोमोलेक्यूलर या पॉलिमर बनाने की इसकी असाधारण क्षमता है, जो इसे सभी ज्ञात जीवन रूपों के एक सामान्य तत्व के रूप में काम करता है।.

ग्रेफाइट और हीरे के रूपों में संयोजन के बिना कार्बन एक रासायनिक तत्व के रूप में प्रकृति में मौजूद है। हालांकि, अधिकांश भाग के लिए इसे रासायनिक कार्बन यौगिकों, जैसे कैल्शियम कार्बोनेट (CaCO) के रूप में मिलाया जाता है।3) और पेट्रोलियम और प्राकृतिक गैस में अन्य यौगिक.
यह एन्थ्रेसाइट, कोयला, लिग्नाइट और पीट जैसे कई खनिजों का निर्माण भी करता है। कार्बन का सबसे बड़ा महत्व यह है कि यह तथाकथित "जीवन के निर्माण खंड" का गठन करता है और सभी जीवित जीवों में मौजूद होता है.
सूची
- 1 कार्बन कहाँ और किस रूप में पाया जाता है?
- 1.1 क्रिस्टल आकार
- 1.2 अनाकार रूप
- 1.3 तेल, प्राकृतिक गैस और कोलतार
- 2 भौतिक और रासायनिक गुण
- २.१ रासायनिक प्रतीक
- २.२ परमाणु संख्या
- २.३ शारीरिक अवस्था
- २.४ रंग
- 2.5 परमाणु द्रव्यमान
- 2.6 गलनांक
- 2.7 क्वथनांक
- 2.8 घनत्व
- 2.9 विलेयता
- 2.10 इलेक्ट्रॉनिक विन्यास
- 2.11 बाहरी या वैलेंस परत में इलेक्ट्रॉनों की संख्या
- 2.12 लिंक क्षमता
- 2.13 कैटेनसीयन
- 3 बायोगैकेमिकल चक्र
- ३.१ प्रकाश संश्लेषण
- 3.2 सांस लेना और सड़ना
- ३.३ भूवैज्ञानिक प्रक्रिया
- 3.4 मानव गतिविधि में हस्तक्षेप
- 4 उपयोग
- 4.1 तेल और प्राकृतिक गैस
- ४.२ ग्रेफाइट
- ४.३ हीरा
- 4.4 एन्थ्रेसाइट
- 4.5 कठिन कोयला
- 4.6 लिग्नाइट
- 4.7 पीट
- 5 संदर्भ
कार्बन कहां और किस रूप में पाया जाता है?
जीवन के सभी रूपों के लिए सामान्य रासायनिक घटक होने के अलावा, प्रकृति में कार्बन तीन क्रिस्टलीय रूपों में मौजूद है: हीरा, ग्रेफाइट और फुलरीन.
कोयला (एन्थ्रेसाइट, लिग्नाइट, कोयला, पीट), तरल रूपों (तेल की किस्मों) और सोडा (प्राकृतिक गैस) के कई अनाकार खनिज रूप भी हैं.
क्रिस्टल आकार
क्रिस्टलीय रूपों में, कार्बन परमाणु ज्यामितीय स्थानिक व्यवस्था के साथ क्रमबद्ध पैटर्न बनाते हैं.
सीसा
यह चमक या धातु की चमक के साथ काले रंग का एक नरम ठोस है और गर्मी (दुर्दम्य) के लिए प्रतिरोधी है। इसकी क्रिस्टलीय संरचना कार्बन परमाणुओं को हेक्सागोनल रिंग्स में शामिल करती है, जो बदले में, एक साथ मिलकर शीट बनाती हैं.
ग्रेफाइट जमा दुर्लभ हैं और चीन, भारत, ब्राजील, उत्तर कोरिया और कनाडा में पाए गए हैं.
हीरा
यह एक बहुत ही कठोर ठोस, ग्रेफाइट की तुलना में प्रकाश और बहुत सघनता के मार्ग के लिए पारदर्शी है: हीरे के घनत्व का मान ग्रेफाइट के लगभग दोगुने के बराबर होता है.
हीरे में कार्बन परमाणु टेट्राहेड्रल ज्यामिति में शामिल हो जाते हैं। इसी तरह, हीरे को ग्रेफाइट से बनाया जाता है जो बहुत उच्च तापमान और दबाव (3000) की स्थितियों के अधीन होता है °सी और 100 000 एटीएम).
अधिकांश हीरे 140 और 190 किमी के बीच मेंटल में स्थित हैं। गहरे ज्वालामुखीय विस्फोटों के माध्यम से, मैग्मा उन्हें सतह के करीब दूरी तक ले जा सकता है.
अफ्रीका (नामीबिया, घाना, कांगो लोकतांत्रिक गणराज्य, सिएरा लियोन और दक्षिण अफ्रीका), अमेरिका (ब्राजील, कोलंबिया, वेनेजुएला, गुयाना, पेरू), ओशिनिया (ऑस्ट्रेलिया) और एशिया (भारत) में हीरे के खेत हैं।.

फुलरीन
वे कार्बन के आणविक रूप हैं जो फ़ुटबॉल गेंदों के समान लगभग गोलाकार अणुओं में 60 और 70 कार्बन परमाणुओं के समूह बनाते हैं.
20 कार्बन परमाणुओं से छोटे फुलरीन भी हैं। फुलरीन के कुछ रूपों में कार्बन नैनोट्यूब और कार्बन फाइबर शामिल हैं.

अनाकार रूप
अनाकार रूपों में कार्बन परमाणु एक व्यवस्थित और नियमित क्रिस्टलीय संरचना का गठन नहीं करते हैं। इसके बजाय, वे अन्य तत्वों से भी अशुद्धियाँ होते हैं.
एन्थ्रेसाइट
यह सबसे पुराना मेटामॉर्फिक खनिज कोयला है (जो तापमान, दबाव या तरल पदार्थों की रासायनिक क्रिया के प्रभाव से चट्टानों के संशोधन से आता है), क्योंकि इसके गठन की तारीख प्राथमिक या पैलियोज़ोइक युग, कार्बोनिफेरस काल से है.
एन्थ्रेसाइट कार्बन का अनाकार रूप है जिसमें इस तत्व की उच्च सामग्री है: 86 और 95% के बीच। यह ग्रे-ब्लैक और मेटालिक ग्लॉस है, और यह भारी और कॉम्पैक्ट है.
आम तौर पर, एन्थ्रेसाइट भूवैज्ञानिक विकृति के क्षेत्रों में पाया जाता है और दुनिया के कोयले के भंडार का लगभग 1% बनता है.
भौगोलिक रूप से यह कनाडा, अमेरिका, दक्षिण अफ्रीका, फ्रांस, ग्रेट ब्रिटेन, जर्मनी, रूस, चीन, ऑस्ट्रेलिया और कोलंबिया में पाया जाता है.

कठिन कोयला
यह एक खनिज कोयला, कार्बनिक मूल की तलछटी चट्टान है, जिसका गठन पैलियोज़ोइक और मेसोज़ोइक युग से होता है। इसमें 75 और 85% के बीच एक कार्बन सामग्री है.
यह काला है, इसे अपारदर्शी होने और एक मैट और चिकना दिखने की विशेषता है, क्योंकि इसमें बिटुमिन पदार्थों की उच्च सामग्री है। यह कार्बोनिफेरस और पर्मियन काल में पेलियोजोइक युग में लिग्नाइट के संपीड़न द्वारा बनाई गई है.
यह ग्रह पर कोयले का सबसे प्रचुर रूप है। संयुक्त राज्य अमेरिका, ग्रेट ब्रिटेन, जर्मनी, रूस और चीन में कोयले के बड़े भंडार हैं.
कोयला
यह संपीड़न (उच्च दबाव) द्वारा पीट से तृतीयक युग में गठित एक जीवाश्म खनिज कोयला है। इसमें कोयले की तुलना में 70 और 80% के बीच कम कार्बन सामग्री होती है.
यह थोड़ी कॉम्पैक्ट सामग्री है, crumbly (विशेषता जो इसे अन्य कार्बन खनिजों से अलग करती है), भूरा या काला। इसकी बनावट लकड़ी के समान है और इसकी कार्बन सामग्री 60 से 75% तक है.
यह एक आसान इग्निशन ईंधन है, जिसमें कम कैलोरी मान और पीट की तुलना में कम पानी की मात्रा होती है.
जर्मनी, रूस, चेक गणराज्य, इटली (वेनेटो क्षेत्र, टस्कनी, उम्ब्रिया) और सार्डिनिया में महत्वपूर्ण लिग्नाइट खदानें हैं। स्पेन में लिग्नाइट जमा अस्टुरियस, अंडोरा, ज़रागोज़ा और ला कोरुना में हैं.
पीट
यह कार्बनिक मूल की एक सामग्री है जिसका गठन क्वाटरनरी युग से आता है, पिछले कोयलों की तुलना में बहुत अधिक हाल ही में.
यह एक भूरे-पीले रंग का रंग है और यह एक कम घनत्व वाले स्पंजी द्रव्यमान के रूप में दिखाई देता है, जिसमें आप देख सकते हैं कि पौधे की उत्पत्ति उस स्थान से हुई है जहाँ इसकी उत्पत्ति हुई थी.
ऊपर उल्लिखित कोयलों के विपरीत, पीट वुडी सामग्री या लकड़ी के कार्बोनाइजेशन की प्रक्रियाओं से नहीं आता है, लेकिन पौधों की जड़ी-बूटियों के संचय से बनाया गया है और मार्सैय- मार्श इलाकों में कार्बोनाइजेशन प्रक्रिया के माध्यम से होता है जो पूरा नहीं हुआ है।.
पीट में पानी की मात्रा अधिक होती है; इस कारण से इसे उपयोग करने से पहले सुखाने और संघनन की आवश्यकता होती है.
इसमें कम कार्बन सामग्री (केवल 55%) है; इसलिए, इसका कम ऊर्जा मूल्य है। जब दहन के अधीन होता है, तो इसका राख अवशेष प्रचुर मात्रा में होता है और बहुत अधिक धुआं उत्सर्जित करता है.
चिली, अर्जेंटीना (टिएरा डेल फुएगो), स्पेन (एस्पिनोसा डी सेराटो, पलेंसिया), जर्मनी, डेनमार्क, हॉलैंड, रूस, फ्रांस में महत्वपूर्ण पीट जमा हैं।.

तेल, प्राकृतिक गैस और कोलतार
तेल (लैटिन से) petrae, जिसका अर्थ है "पत्थर"; और ओलियम, जिसका अर्थ है "तेल": "रॉक ऑयल") कई कार्बनिक यौगिकों का मिश्रण है - अधिकांश हाइड्रोकार्बन - कार्बनिक पदार्थों के अवायवीय जीवाणु अपघटन (ऑक्सीजन की अनुपस्थिति में) द्वारा उत्पादित.
इसने सबसॉइल में, बड़ी गहराई पर और विशेष परिस्थितियों में दोनों भौतिक (उच्च दबाव और तापमान) और रासायनिक (विशिष्ट उत्प्रेरक यौगिकों की उपस्थिति) में एक प्रक्रिया बनाई, जिसमें लाखों साल लगे.
इस प्रक्रिया के दौरान C और H को कार्बनिक ऊतकों से मुक्त कर दिया गया और पुन: संयोजित होकर पुनः एक बड़ी संख्या में हाइड्रोकार्बन बनाने के लिए जो कि उनके गुणों के अनुसार मिश्रित होते हैं, प्राकृतिक गैस, तेल और कोलतार बनाते हैं।.
ग्रह के तेल क्षेत्र मुख्य रूप से वेनेजुएला, सऊदी अरब, इराक, ईरान, कुवैत, संयुक्त अरब अमीरात, रूस, लीबिया, नाइजीरिया और कनाडा में स्थित हैं।.
रूस, ईरान, वेनेजुएला, कतर, संयुक्त राज्य अमेरिका, सऊदी अरब और संयुक्त अरब अमीरात में प्राकृतिक गैस के भंडार हैं।.
भौतिक और रासायनिक गुण
कार्बन गुणों के बीच हम निम्नलिखित का उल्लेख कर सकते हैं:
रासायनिक प्रतीक
सी.
परमाणु संख्या
6.
भौतिक अवस्था
दबाव और तापमान की सामान्य परिस्थितियों में ठोस (1 वातावरण और 25) °सी).
रंग
ग्रे (ग्रेफाइट) और पारदर्शी (हीरा).
परमाणु द्रव्यमान
12,011 जी / मोल.
गलनांक
500 °सी.
क्वथनांक
827 °सी.
घनत्व
2.62 ग्राम / सेमी3.
घुलनशीलता
पानी में अघुलनशील, कार्बन टेट्राक्लोराइड CCl में घुलनशील4.
इलेक्ट्रॉनिक कॉन्फ़िगरेशन
1s2 2s2 2p2.
बाहरी परत या वैलेंस में इलेक्ट्रॉनों की संख्या
4.
लिंक की क्षमता
4.
श्रृंखलन
इसमें लंबी श्रृंखलाओं में रासायनिक यौगिक बनाने की क्षमता है.
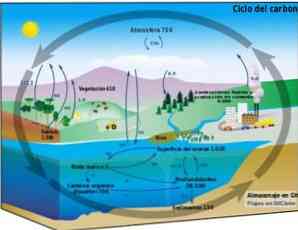
बायोगेकेमिकल चक्र
कार्बन चक्र एक गोलाकार जैव-रासायनिक प्रक्रिया है, जिसके माध्यम से कार्बन का जैवमंडल, वायुमंडल, जलमंडल और स्थलीय लिथोस्फीयर के बीच आदान-प्रदान किया जा सकता है.
पृथ्वी पर इस चक्रीय कार्बन प्रक्रिया का ज्ञान इस चक्र पर मानव कार्रवाई और वैश्विक जलवायु परिवर्तन पर इसके परिणामों को प्रदर्शित करना संभव बनाता है.
कार्बन महासागरों और पानी के अन्य पिंडों के साथ-साथ लिथोस्फीयर के बीच, मिट्टी और उप-वातावरण में, वायुमंडल में और जीवमंडल में घूम सकता है। वायुमंडल और जलमंडल में कार्बन सीओ के रूप में गैसीय रूप में मौजूद है2 (कार्बन डाइऑक्साइड).
प्रकाश संश्लेषण
वातावरण में कार्बन पारिस्थितिक तंत्र के स्थलीय और जलीय जीवों द्वारा कब्जा कर लिया जाता है (प्रकाश संश्लेषक जीव).
प्रकाश संश्लेषण सीओ के बीच एक रासायनिक प्रतिक्रिया होने की अनुमति देता है2 और पानी, सौर ऊर्जा और पौधों से क्लोरोफिल द्वारा मध्यस्थता, कार्बोहाइड्रेट या शर्करा का उत्पादन करने के लिए। यह प्रक्रिया कम सीओ ऊर्जा सामग्री के साथ सरल अणुओं को बदल देती है2, एच2ओ और ऑक्सीजन ओ2, उच्च ऊर्जा के जटिल आणविक रूपों में, जो शर्करा हैं.
हेटरोट्रॉफ़िक जीव - जो प्रकाश संश्लेषण को अंजाम नहीं दे सकते हैं और जो पारिस्थितिक तंत्र में उपभोक्ता हैं - उत्पादकों और अन्य उपभोक्ताओं को खिलाते समय कार्बन और ऊर्जा प्राप्त करते हैं।.
श्वास और अपघटन
श्वास और अपघटन जैविक प्रक्रियाएं हैं जो सीओ के रूप में पर्यावरण को कार्बन मुक्त करती हैं2 या सी.एच.4 (एनारोबिक अपघटन में उत्पादित मीथेन, ऑक्सीजन की अनुपस्थिति में).
भूवैज्ञानिक प्रक्रियाओं
भूवैज्ञानिक प्रक्रियाओं के माध्यम से और समय बीतने के परिणामस्वरूप, एनारोबिक अपघटन के कार्बन को तेल, प्राकृतिक गैस और कोयले जैसे जीवाश्म ईंधन में परिवर्तित किया जा सकता है। इसी तरह, कार्बन भी अन्य खनिजों और चट्टानों का हिस्सा है.
मानव गतिविधि में हस्तक्षेप
जब मनुष्य ऊर्जा के लिए जीवाश्म ईंधन के जलने का उपयोग करता है, तो कार्बन भारी मात्रा में सीओ के रूप में वायुमंडल में लौट आता है2 यह कार्बन के प्राकृतिक जैव-रासायनिक चक्र द्वारा आत्मसात नहीं किया जा सकता है.
यह अतिरिक्त सीओ2 मानव गतिविधि द्वारा उत्पादित कार्बन चक्र के संतुलन को नकारात्मक रूप से प्रभावित करता है और यह ग्लोबल वार्मिंग का मुख्य कारण है.
अनुप्रयोगों
कार्बन और इसके यौगिकों के उपयोग अत्यंत विविध हैं। निम्नलिखित के साथ सबसे उत्कृष्ट:
तेल और प्राकृतिक गैस
कार्बन के मुख्य आर्थिक उपयोग को मिथाइल गैस और पेट्रोलियम जैसे जीवाश्म ईंधन हाइड्रोकार्बन के रूप में इसके उपयोग में दर्शाया गया है।.
तेल गैसोलीन, डीजल, केरोसिन, डामर, स्नेहक, सॉल्वैंट्स और अन्य जैसे कई डेरिवेटिव प्राप्त करने के लिए रिफाइनरियों में आसुत है, जो बदले में पेट्रोकेमिकल उद्योग में उपयोग किया जाता है जो प्लास्टिक, उर्वरक, फार्मास्यूटिकल्स और पेंट उद्योग के लिए कच्चे माल का उत्पादन करता है। , दूसरों के बीच में.
सीसा
ग्रेफाइट का उपयोग निम्नलिखित क्रियाओं में किया जाता है:
- इसका उपयोग पेन्सिल के निर्माण में किया जाता है, जिसे क्ले के साथ मिलाया जाता है.
- यह आग रोक ईंटों और क्रूसिबल, गर्मी प्रतिरोधी के निर्माण का हिस्सा है.
- विभिन्न यांत्रिक उपकरणों में जैसे वाशर, बियरिंग्स, पिस्टन और गास्केट.
- यह एक उत्कृष्ट ठोस स्नेहक है.
- इसकी विद्युत चालकता और इसकी रासायनिक जड़ता के कारण, इसका उपयोग इलेक्ट्रोड, इलेक्ट्रिक मोटर कोयल्स के निर्माण में किया जाता है.
- इसका उपयोग परमाणु ऊर्जा संयंत्रों में एक मध्यस्थ के रूप में किया जाता है.
हीरा
डायमंड में विशेष रूप से असाधारण भौतिक गुण होते हैं, जैसे कि उच्च डिग्री कठोरता और तापीय चालकता जो अब तक ज्ञात है.
ये सुविधाएँ अपने उच्च अपघर्षकता के लिए कटौती और चमकाने के उपकरण बनाने के लिए उपयोग किए जाने वाले औजारों में औद्योगिक अनुप्रयोगों की अनुमति देती हैं.
पारदर्शिता के रूप में इसके ऑप्टिकल गुण और सफेद रोशनी को तोड़ने और प्रकाश को अपवर्तित करने की क्षमता- इसे ऑप्टिकल उपकरणों में कई अनुप्रयोग देते हैं, जैसे कि लेंस और प्रिज्म के निर्माण में.
इसके ऑप्टिकल गुणों से प्राप्त विशेषता चमक भी गहने उद्योग में बहुत सराहना की जाती है.
एन्थ्रेसाइट
एन्थ्रेसाइट को प्रज्वलित करने में कठिनाई होती है, धीमी गति से जलती है और बहुत अधिक ऑक्सीजन की आवश्यकता होती है। इसके दहन से हल्के नीले रंग की हल्की ज्वाला निकलती है और बहुत अधिक गर्मी निकलती है.
कुछ साल पहले, थर्मोइलेक्ट्रिक पौधों और घरेलू हीटिंग के लिए एन्थ्रेसाइट का उपयोग किया गया था। इसके उपयोग के फायदे हैं जैसे कि थोड़ी राख या धूल, थोड़ा धुआं और धीमी दहन प्रक्रिया का उत्पादन.
इसकी उच्च आर्थिक लागत और कमी के कारण, एन्थ्रासाइट को थर्मोइलेक्ट्रिक पौधों में प्राकृतिक गैस और घरों में विद्युत शक्ति द्वारा प्रतिस्थापित किया गया है.
कठिन कोयला
कोयला कच्चे माल के रूप में उपयोग किया जाता है:
- कोक, स्टील मिलों में ब्लास्ट फर्नेस से ईंधन.
- क्रेओसोट, कठोर कोयले से टार डिस्टिल्ट्स को प्राप्त करने और मौसम के संपर्क में आने वाली लकड़ी के लिए एक सुरक्षात्मक सीलेंट के रूप में उपयोग किया जाता है.
- Cresol (रासायनिक मेथिलफेनोल) कोयले से निकाला जाता है और एक कीटाणुनाशक और एंटीसेप्टिक के रूप में उपयोग किया जाता है,
- अन्य डेरिवेटिव जैसे कि गैस, टार या पिच, और इत्र, कीटनाशक, प्लास्टिक, पेंट, टायर और सड़क फुटपाथ के निर्माण में उपयोग किए जाने वाले यौगिक।.
कोयला
लिग्नाइट मध्यम गुणवत्ता के ईंधन का प्रतिनिधित्व करता है। जेट, लिग्नाइट की विविधता, को कार्बनीकरण और उच्च दबाव की लंबी प्रक्रिया द्वारा बहुत कॉम्पैक्ट होने की विशेषता है, और इसका उपयोग गहने और अलंकरण में किया जाता है.
पीट
पीट का उपयोग निम्नलिखित गतिविधियों में किया जाता है;
- पौधों की प्रजातियों के विकास, समर्थन और परिवहन के लिए.
- जैविक खाद के रूप में.
- अस्तबल में जानवरों के बिस्तर के रूप में.
- कम गुणवत्ता वाले ईंधन के रूप में.
संदर्भ
- बरोज़, ए।, होलमैन, जे।, पार्सन्स, ए।, पिलिंग, जी। और मूल्य, जी। (2017)। रसायन विज्ञान 3: अकार्बनिक, जैविक और भौतिक रसायन विज्ञान का परिचय। ऑक्सफोर्ड यूनिवर्सिटी प्रेस.
- डेमिंग, ए। (2010)। तत्वों का राजा? नैनो। 21 (30): 300201. डोई: 10.1088
- डिनेवेबेल, एम।, वेरहोवेन, जी।, प्रदीप, एन।, फ्रेनकेन, जे।, हेमबर्ग, जे। और ज़ैंडबर्गेन, एच। (2004)। ग्रेफाइट की सुपर चिकनाई। शारीरिक समीक्षा पत्र। 92 (12): 126101. डोई: 10.1103
- इरिफ्यून, टी।, कुरियो, ए।, सकामोटो, एस।, इनौए, टी। और सुमिया, एच। (2003)। सामग्री: ग्रेफाइट से अल्ट्राहाइड पॉलीक्रिस्टलाइन हीरा। प्रकृति। 421 (6923): 599-600। doi: 10.1038
- सव्वतिस्मि, ए। (2005)। ग्रेफाइट के पिघलने बिंदु और तरल कार्बन के गुणों की माप (1963-2003 के लिए एक समीक्षा)। कार्बन। 43 (6): 1115. डोई: 10.1016


