डाल्टन के परमाणु मॉडल का अनुकरण करता है
डाल्टन के परमाणु मॉडल या डाल्टन का परमाणु सिद्धांत, यह अंग्रेजी केमिस्ट और गणितज्ञ जॉन डाल्टन द्वारा 1803 और 1807 के बीच प्रस्तुत किया गया एक प्रस्ताव था। परमाणुओं की संरचना और कार्यप्रणाली के बारे में वैचारिक संगठन का यह पहला प्रस्ताव था.
डाल्टन मॉडल को एक गोलाकार मॉडल के रूप में भी जाना जाता है, क्योंकि यह इस तथ्य का प्रस्ताव करता है कि परमाणु एक अविभाज्य, ठोस और कॉम्पैक्ट क्षेत्र है। इस मॉडल के लिए धन्यवाद दुनिया के बाकी हिस्सों के लिए रसायन विज्ञान के बारे में स्पष्टीकरण प्रदान करना बहुत आसान था और यह कई नवीन अनुसंधान परियोजनाओं का आधार था जो इसके बाद आए। यह बता सकता है कि कुछ राज्यों में पदार्थों की प्रतिक्रिया क्यों हुई.
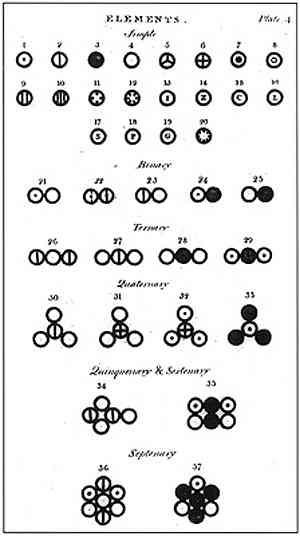
डाल्टन के अनुसार, पदार्थ परमाणु नामक एक न्यूनतम इकाई से बना था, जिसे किसी भी तरह से नष्ट या विभाजित नहीं किया जा सकता था। यह इकाई, जिसे पूर्व में डेमोक्रिटस और उनके गुरु लीउसीपो ने प्रस्तावित किया था, डाल्टन के शोध और उनके परमाणु मॉडल के निर्माण का आधार था।.
इस परमाणु सिद्धांत के साथ, जॉन डाल्टन ने परमाणु (ब्रह्मांड के परमाणु सिद्धांत) के अस्तित्व पर ग्रीक दार्शनिकों के विचारों को लेने की कोशिश की, लेकिन एक मंच के रूप में विभिन्न प्रयोगशाला प्रयोगों का उपयोग करके उन्हें अपने विचारों को प्रदर्शित करने की अनुमति दी।.
सूची
- 1 डाल्टन एटॉमिक मॉडल के पोस्टयूलेट
- १.१ पद १
- १.२ पद २
- १.३ पोस्ट ३
- १.४ पद ४
- १.५ पश्चात ५
- १.६ पद ६
- 2 डाल्टन के परमाणु मॉडल की त्रुटियां
- २.१ जल सूत्र
- २.२ परमाणुओं की रचना
- 3 निष्कर्ष
- 4 डाल्टन का मुख्य योगदान
- ४.१ परमाणु सिद्धांतों का पूर्वगामी
- ४.२ उन्होंने आधुनिक रसायन विज्ञान की नींव रखी
- 4.3 रासायनिक भार की तालिका प्रकाशित करने के लिए सबसे पहले
- 4.4 रंग अंधापन को नाम दें
- रुचि के 5 लेख
- 6 संदर्भ
डाल्टन परमाणु मॉडल के पोस्टुलेट्स
डाल्टन ने 6 परमाणुओं के साथ अपना परमाणु मॉडल तैयार किया, जिसमें उन्होंने बताया कि कैसे उन्होंने अपनी पढ़ाई को आधार बनाया और कैसे उन्हें पूरा किया.
पोस्ट 1

उपरोक्त छवि में डाल्टन के मॉडल का एक सारांश दर्शाया गया है: परमाणु छोटे गोले होंगे जो अविभाज्य, अविनाशी और सजातीय होंगे।.
डाल्टन के पहले अभिभाषण में कहा गया है कि तत्व छोटे कणों से बने होते हैं जिन्हें परमाणु कहा जाता है, जिन्हें विभाजित नहीं किया जा सकता है और न ही उन्हें नष्ट किया जा सकता है.
साथ ही, डाल्टन ने टिप्पणी की कि ये कण किसी भी रासायनिक प्रतिक्रिया में नहीं बदल सकते हैं.
पोस्ट 2

डाल्टन के दूसरे दृष्टिकोण ने स्थापित किया कि एक ही तत्व में मौजूद सभी परमाणु अन्य विशेषताओं की तरह वजन में बराबर हैं.
दूसरी ओर, यह भी स्थापित किया गया कि विभिन्न तत्वों के परमाणुओं का द्रव्यमान अलग-अलग होता है। इस प्रस्ताव से हाइड्रोजन के साथ विभिन्न तत्वों की तुलना करते समय प्रदर्शित होने वाले सापेक्ष परमाणु भार का ज्ञान हुआ.
पोस्ट ३

डाल्टन के तीसरे आसन ने स्थापित किया कि रासायनिक प्रतिक्रियाओं में संयुक्त होने पर भी परमाणु अविभाज्य होते हैं। न ही इन्हें बनाया या नष्ट किया जा सकता है.
परमाणुओं का संयोजन, दोनों समान और भिन्न, अधिक जटिल यौगिक उत्पन्न करेंगे, लेकिन यह प्रक्रिया इस तथ्य को नहीं बदलेगी कि परमाणु पदार्थ की न्यूनतम इकाई है.
4 का आसन करें
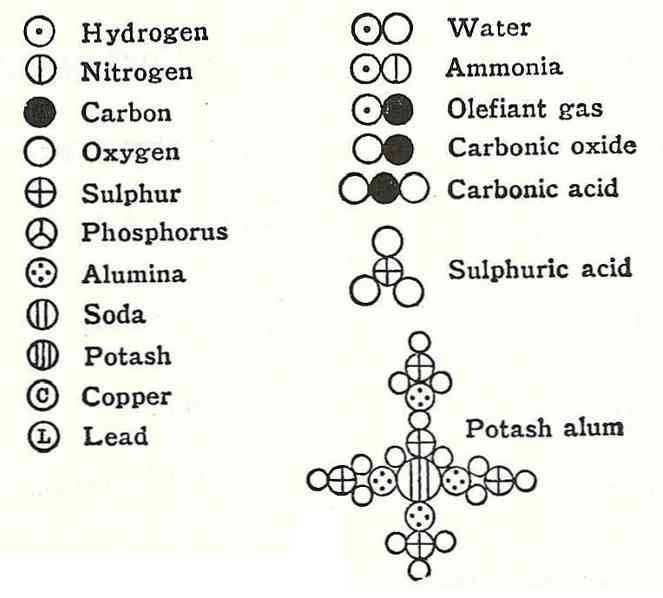
डाल्टन के चौथे अभिधारणा ने स्थापित किया कि जब परमाणुओं को एक यौगिक बनाने के लिए संयुक्त किया जाता है, तो भी उनके पास हमेशा एक संबंध होगा जिसे सरल और पूर्ण संख्या में व्यक्त किया जा सकता है। यह अभिव्यक्ति भिन्नों में नहीं दिखाई जाएगी, क्योंकि परमाणु अविभाज्य हैं.
५ का अनुकरण करें
डाल्टन के पांचवे पदावली में कहा गया है कि एक से अधिक यौगिक बनाने के लिए अलग-अलग अनुपात में अलग-अलग परमाणुओं का संभावित संयोजन होता है.
इस तरह, यह समझाया जा सकता है कि परमाणुओं की एक सीमित मात्रा से ब्रह्मांड में सभी मौजूदा पदार्थ आ गए हैं.
६ पर आसन करें
डाल्टन के छठे और अंतिम पोस्टुलेट ने कहा कि प्रत्येक और हर रासायनिक यौगिक दो या दो से अधिक विभिन्न तत्वों के परमाणुओं के संयोजन से बनाया गया था.
डाल्टन परमाणु मॉडल की त्रुटियां
विज्ञान की दुनिया में सभी सिद्धांत की तरह, डाल्टन द्वारा प्रस्तावित मॉडल के संबंध में कई खंडन थे, जो कि डाल्टन के अभिनव विचारों को पीछे छोड़ते हुए वर्षों में प्रदर्शित किए गए थे.
जल का सूत्र
इसका एक उदाहरण डाल्टन द्वारा पानी के फार्मूले पर दिए गए तर्क थे, जो उन्होंने कहा कि एक हाइड्रोजन और एक ऑक्सीजन से बना था.
इस बयान के कारण कुछ बुनियादी यौगिकों के द्रव्यमान और वजन के संबंध में गणना की कई त्रुटियां थीं जो उस जानकारी पर आधारित थीं.
कुछ साल बाद, यूरोपीय वैज्ञानिकों गे-लुसाक और अलेक्जेंडर वॉन हम्बोड्ट ने इस जानकारी का खंडन किया और साबित किया कि पानी वास्तव में दो हाइड्रोजेन और एक ऑक्सीजन से बना था। 6 साल बाद अमाडेओ एवोगाद्रो ने पानी की सटीक संरचना को इंगित किया और इसकी वजह से एवोगैड्रो का नियम है.
परमाणुओं की संरचना
दूसरी ओर, बीसवीं शताब्दी में परमाणुओं की वास्तविक संरचना का पता चला था। इस मामले में यह दिखाया गया कि प्रोटॉन, इलेक्ट्रॉनों और न्यूट्रॉन जैसी छोटी इकाई है.
इसी तरह, मेंडेलीव और मेयर की आवर्त सारणी में स्थापित विभिन्न परमाणु भारों का अस्तित्व, समस्थानिकों का अस्तित्व और अधिक विशिष्ट रासायनिक गुणों के कारण आया।.
निष्कर्ष
उनकी त्रुटियों के बावजूद, जॉन डाल्टन का योगदान विज्ञान की दुनिया में काफी प्रासंगिक था और उनके द्वारा प्रदान की गई बड़ी मात्रा में जानकारी के कारण उनके समय में हलचल मच गई थी.
आपके वैज्ञानिक योगदान अभी भी मान्य हैं और अभी भी अध्ययन किए जा रहे हैं.
डाल्टन के परमाणु मॉडल पर विज्ञान की दुनिया में प्रासंगिकता और विज्ञान के इतिहास में उस समय प्रस्तुत किए गए अन्वेषणों और परिकल्पनाओं के बारे में इसकी सही व्याख्या के कारण दशकों से सवाल नहीं उठाया गया था।.
डाल्टन का मुख्य योगदान है
विज्ञान की दुनिया में उनका योगदान मुख्य रूप से मात्रात्मक परीक्षणों के माध्यम से प्रकृति के बारे में परिकल्पना को स्पष्ट और तैयार करना था.
27 जुलाई, 1884 को मैनचेस्टर में दिल का दौरा पड़ने से वैज्ञानिक की मृत्यु हो गई और कुछ ही समय बाद राजशाही से सम्मान मिला.
परमाणु सिद्धांतों का पूर्वगामी
जॉन डाल्टन एक अंग्रेजी रसायनज्ञ, गणितज्ञ और रसायनज्ञ थे। उनका जन्म 6 सितंबर, 1766 को कंबरलैंड, यूनाइटेड किंगडम में हुआ था, और उस समय के परमाणु सिद्धांतों के अग्रदूतों में से एक के रूप में जाना जाता है, जब उन्होंने अपना परमाणु मॉडल प्रस्तुत किया था।.
उन्होंने आधुनिक रसायन विज्ञान की नींव रखी
डाल्टन रासायनिक तत्वों के लिए सापेक्ष भार की एक तालिका बनाने में अग्रदूतों में से एक के रूप में जाना जाता है। इस तथ्य ने आधुनिक रसायन विज्ञान के रूप में आज हम जो भी जानते हैं उसकी नींव रखने में मदद की.
रासायनिक भार की तालिका प्रकाशित करने के लिए सबसे पहले
डाल्टन पहले वैज्ञानिक थे जिन्हें परमाणु भार की एक तालिका प्रकाशित करने का सम्मान था, जिसमें हाइड्रोजन, ऑक्सीजन, फास्फोरस, कार्बन और सल्फर जैसे तत्व शामिल थे। इस प्रकाशन के लिए धन्यवाद डाल्टन ने काम करना शुरू कर दिया और अपने परमाणु मॉडल को ढालना था.
रंग अंधापन को नाम दें
यह ध्यान दिया जाना चाहिए कि डाल्टन रंगों को पकड़ने के लिए दृश्य समस्याओं के साथ पंजीकृत पहले लोगों में से एक थे और उनके कारण इस स्थिति को रंग स्थिरता नाम दिया गया है.
रुचि के लेख
श्रोडिंगर का परमाणु मॉडल.
ब्रोगली का परमाणु मॉडल.
चाडविक का परमाणु मॉडल.
हाइजेनबर्ग का परमाणु मॉडल.
पेरिन का परमाणु मॉडल.
थॉमसन का परमाणु मॉडल.
डीराक जॉर्डन का परमाणु मॉडल.
डेमोक्रिटस का परमाणु मॉडल.
बोहर का परमाणु मॉडल.
संदर्भ
- डाल्टन का परमाणु सिद्धांत। 24 नवंबर, 2017 को खानसैकेमी: www.khanacademy.org से लिया गया
- डाल्टन का परमाणु सिद्धांत। 24 नवंबर, 2017 को इंडियाना यूनिवर्सिटी नॉर्थवेस्ट: iun.edu से लिया गया
- परमाणु सिद्धांत। 24 नवंबर, 2017 को एनसाइक्लोपीडिया ब्रिटानिका: www.britannica.com से लिया गया
- परमाणु सिद्धांत। 24 नवंबर, 2017 को विकिपीडिया: en.wikipedia.org से पुनः प्राप्त
- परमाणु संरचना का इतिहास। 24 नवंबर, 2017 को लुमेन से प्राप्त किया गया: courses.lumenlearning.com.


