बोरान ऑक्साइड (बी 2 ओ 3) संरचना, गुण, नामकरण और उपयोग
बोरान ऑक्साइड या बोरिक एनहाइड्राइड एक अकार्बनिक यौगिक है जिसका रासायनिक सूत्र B है2हे3. पीरियोडिक टेबल के पी ब्लॉक के बोरॉन और ऑक्सीजन तत्व, और यहां तक कि उनके संबंधित समूहों के अधिक प्रमुखों के रूप में, उनके बीच विद्युतीयता का अंतर बहुत अधिक नहीं है; इसलिए, यह उम्मीद की जानी चाहिए कि बी2हे3 प्रकृति में सहसंयोजक बनें.
बी2हे3 यह पिघलने वाली भट्टी के भीतर और 750 डिग्री सेल्सियस के तापमान में केंद्रित सल्फ्यूरिक एसिड में बोरेक्स को भंग करके तैयार किया जाता है; ऊष्मीय निर्जलीकरण बोरिक एसिड, B (OH)3, लगभग 300 डिग्री सेल्सियस के तापमान पर; या इसे डिबोरेन प्रतिक्रिया (बी) के उत्पाद के रूप में भी बनाया जा सकता है2एच6) ऑक्सीजन के साथ.

बोरॉन ऑक्साइड में एक अर्धवृत्ताकार ग्लासी या क्रिस्टलीय उपस्थिति हो सकती है; बाद में पाउडर के रूप में पीसकर प्राप्त किया जा सकता है (शीर्ष छवि).
हालांकि यह पहली नजर में नहीं लग सकता है, इसे बी माना जाता है2हे3 सबसे जटिल अकार्बनिक आक्साइड में से एक; न केवल एक संरचनात्मक दृष्टिकोण से, बल्कि उन वैरिएबल गुणों के कारण भी, जो चश्मा और चीनी मिट्टी की चीज़ें प्राप्त करते हैं, जिससे वे अपने मैट्रिक्स में जुड़ जाते हैं.
सूची
- 1 बोरॉन ऑक्साइड की संरचना
- १.१ यूनिट BO3
- 1.2 क्रिस्टल संरचना
- १.३ विट्रा संरचना
- 2 गुण
- २.१ शारीरिक रूप
- २.२ आणविक द्रव्यमान
- 2.3 स्वाद
- 2.4 घनत्व
- 2.5 गलनांक
- 2.6 क्वथनांक
- 2.7 स्थिरता
- 3 नामकरण
- 4 उपयोग
- 4.1 बोरोन ट्राइहलाइड्स का संश्लेषण
- 4.2 कीटनाशक
- 4.3 धातु आक्साइड का विलायक: चश्मा, चीनी मिट्टी की चीज़ें और बोरान मिश्र धातुओं का निर्माण
- 4.4 बाइंडर
- 5 संदर्भ
बोरान ऑक्साइड की संरचना
बीओ यूनिट3
बी2हे3 एक सहसंयोजक ठोस है, इसलिए सिद्धांत रूप में इसकी संरचना में कोई बी आयन नहीं हैं3+ न ओ2-, लेकिन बी-ओ लिंक। बोरॉन, वैलेंस बांड सिद्धांत (वीटीई) के अनुसार, केवल तीन सहसंयोजक बांड बना सकते हैं; इस मामले में, तीन बी-ओ लिंक। इसके परिणामस्वरूप, अपेक्षित ज्यामिति को त्रिकोणीय, बीओ होना चाहिए3.
बो अणु3 यह इलेक्ट्रॉनों, विशेष रूप से ऑक्सीजन परमाणुओं में कमी है; हालांकि, उनमें से कई ने कहा कि कमी की आपूर्ति करने के लिए एक दूसरे के साथ बातचीत कर सकते हैं। तो, त्रिकोण बीओ3 वे एक ऑक्सीजन ब्रिज साझा करके जुड़ते हैं, और उन्हें अपने विमानों के साथ त्रिकोणीय पंक्ति नेटवर्क के रूप में अंतरिक्ष में वितरित किया जाता है.
क्रिस्टल संरचना
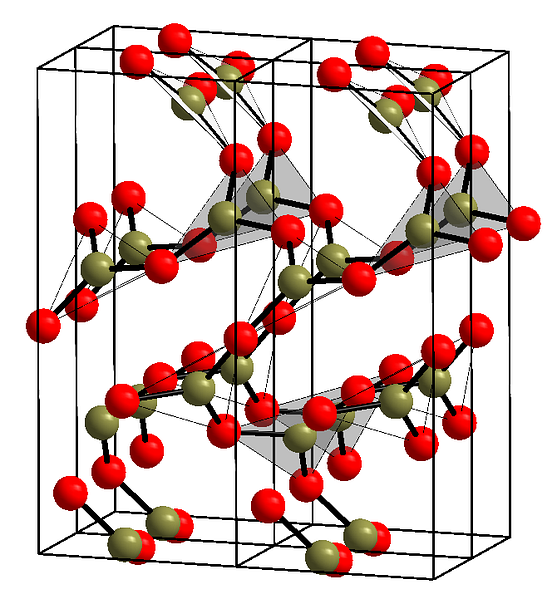
ऊपरी छवि त्रिकोणीय इकाइयों बीओ के साथ उक्त पंक्तियों का एक उदाहरण दिखाती है3. यदि आप ध्यान से देखें, तो विमानों के सभी चेहरे पाठक की ओर नहीं, बल्कि दूसरी तरफ इशारा करते हैं। इन चेहरों का झुकाव बी को परिभाषित करने के तरीके के लिए जिम्मेदार हो सकता है2हे3 एक निश्चित तापमान और दबाव पर.
जब इन नेटवर्कों में एक लंबी दूरी की संरचनात्मक पैटर्न होती है, तो यह एक क्रिस्टलीय ठोस होता है, जिसका निर्माण इसकी इकाई कोशिका से किया जा सकता है। यह वह जगह है जहां बी कहा जाता है2हे3 इसके दो क्रिस्टलीय पॉलीमोर्फ हैं: α और ine.
Α- बी2हे3 परिवेश दबाव (1 एटीएम) पर होता है, और कहा जाता है कि काइनेटिक रूप से अस्थिर; वास्तव में, यह एक कारण है कि बोरान ऑक्साइड शायद मुश्किल क्रिस्टलीकरण का एक यौगिक है.
अन्य बहुरूपक, β-B2हे3, यह GPa की सीमा में उच्च दबाव में प्राप्त किया जाता है; इसलिए, इसका घनत्व α-B से अधिक होना चाहिए2हे3.
विट्रो संरचना
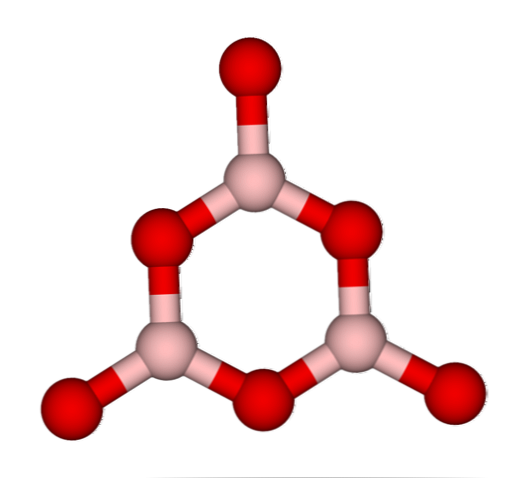
नेटवर्क बीओ3 स्वाभाविक रूप से वे अनाकार संरचनाओं को अपनाते हैं; ये हैं, कि एक पैटर्न की कमी है जो ठोस में अणुओं या आयनों का वर्णन करता है। बी को संश्लेषित करके2हे3 इसका प्रमुख रूप अनाकार है और क्रिस्टलीय नहीं है; सही शब्दों में: यह क्रिस्टलीय की तुलना में ठोस ठोस पदार्थ है.
तब कहा जाता है कि बी2हे3 जब इसका बीओ नेटवर्क होता है तो यह विट्रो या अनाकार होता है3 वे गन्दे हैं। इतना ही नहीं, बल्कि, वे एक साथ आने के तरीके को भी बदलते हैं। एक त्रिकोणीय ज्यामिति में व्यवस्थित होने के बजाय, वे अंत में यह बनाने के लिए जुड़े हुए हैं कि शोधकर्ताओं ने बोरोक्सोल रिंग (शीर्ष छवि) को क्या कहा है.
त्रिकोणीय और हेक्सागोनल इकाइयों के बीच स्पष्ट अंतर पर ध्यान दें। त्रिकोणीय वाले बी को चिह्नित करते हैं2हे3 क्रिस्टलीय, और हेक्सागोनल से बी2हे3 कांच का। इस अनाकार चरण को संदर्भित करने का एक और तरीका बोरॉन ग्लास है, या एक सूत्र द्वारा: जी-बी2हे3 ('जी' शब्द ग्लासी से आता है, अंग्रेजी में).
इस प्रकार, जी-बी नेटवर्क2हे3 वे बोरोक्सोल रिंग से बने होते हैं न कि बीओ यूनिट से3. हालाँकि, जी-बी2हे3 α-B को क्रिस्टलीकृत कर सकते हैं2हे3, जो कि रिंग से लेकर त्रिकोण तक एक-दूसरे से जुड़ा होगा, और प्राप्त क्रिस्टलीकरण की डिग्री को भी परिभाषित करेगा.
गुण
शारीरिक रूप
यह रंगहीन और कांचयुक्त ठोस होता है। अपने क्रिस्टलीय रूप में यह सफेद रंग का होता है.
आणविक द्रव्यमान
69.6182 ग्राम / मोल.
स्वाद
थोड़ा कड़वा
घनत्व
-क्रिस्टलीय: 2.46 ग्राम / एमएल.
-वाइट्रस: 1.80 ग्राम / एमएल.
गलनांक
इसमें पूरी तरह से परिभाषित पिघलने बिंदु नहीं है, क्योंकि यह इस बात पर निर्भर करता है कि यह क्रिस्टलीय या विटेरियस कैसे है। विशुद्ध रूप से क्रिस्टलीय रूप 450 ° C पर पिघला देता है; हालाँकि, कांच का आकार 300 से 700 .C तक के तापमान में पिघला देता है.
क्वथनांक
फिर, रिपोर्ट किए गए मान इस मान से मेल नहीं खाते हैं। स्पष्ट रूप से तरल बोरान ऑक्साइड (इसके क्रिस्टल या उसके गिलास से पिघलाया जाता है) 1860ºC पर उबलता है.
स्थिरता
इसे सूखा रखा जाना चाहिए, क्योंकि यह नमी को बोरिक एसिड में बदलने के लिए अवशोषित करता है, बी (ओएच)3.
शब्दावली
बोरान ऑक्साइड को अन्य तरीकों से नाम दिया जा सकता है, जैसे:
-Diboro trioxide (व्यवस्थित नामकरण).
-बोरान ऑक्साइड (III) (स्टॉक नामकरण).
-बोरिक ऑक्साइड (पारंपरिक नामकरण).
अनुप्रयोगों
बोरॉन ऑक्साइड के कुछ उपयोग इस प्रकार हैं:
बोरोन ट्राइहलाइड्स का संश्लेषण
B से2हे3 बोरान trihalides संश्लेषित किया जा सकता है, BX3 (X = F, Cl और Br)। ये यौगिक लुईस एसिड हैं, और उनके साथ नए गुणों के साथ अन्य डेरिवेटिव प्राप्त करने के लिए कुछ अणुओं के लिए बोरान परमाणुओं को पेश करना संभव है.
कीटनाशक
बोरिक एसिड के साथ एक ठोस मिश्रण, बी2हे3-B (OH)3, एक सूत्र का प्रतिनिधित्व करता है जो घरेलू कीटनाशक के रूप में उपयोग किया जाता है.
धातु आक्साइड का विलायक: चश्मा, चीनी मिट्टी की चीज़ें और बोरान मिश्र धातुओं का निर्माण
तरल बोरान ऑक्साइड धातु ऑक्साइड को भंग करने में सक्षम है। इस परिणामी मिश्रण से, एक बार ठंडा होने के बाद, बोरान और धातुओं द्वारा ठोस पदार्थ प्राप्त किए जाते हैं.
बी की मात्रा पर निर्भर करता है2हे3 उपयोग किया जाता है, साथ ही तकनीक, और धातु ऑक्साइड के प्रकार, आप ग्लास (बोरोसिलिकेट्स), सिरेमिक (नाइट्राइड और बोरान कार्बाइड) की एक समृद्ध विविधता प्राप्त कर सकते हैं, और मिश्र धातु (केवल धातु का उपयोग किया जाता है).
सामान्य तौर पर, कांच या मिट्टी के पात्र अधिक मजबूती और शक्ति प्राप्त करते हैं, साथ ही साथ अधिक स्थायित्व भी। चश्मे के मामले में, वे ऑप्टिकल लेंस और दूरबीनों के लिए, और इलेक्ट्रॉनिक उपकरणों के लिए उपयोग किए जा रहे हैं.
बांधने की मशीन
स्टील पिघलने वाली भट्टियों के निर्माण में, मैग्नीशियम बेस के साथ दुर्दम्य ईंटों का उपयोग किया जाता है। उनमें, बोरान ऑक्साइड को एक बांधने की मशीन के रूप में उपयोग किया जाता है, जिससे उन्हें कसकर बांधने में मदद मिलती है.
संदर्भ
- कंपकंपी और एटकिंस। (2008)। अकार्बनिक रसायन (चौथा संस्करण)। मैक ग्रे हिल.
- विकिपीडिया। (2019)। बोरान ट्राईऑक्साइड। से लिया गया: en.wikipedia.org
- PubChem। (2019)। बोरिक ऑक्साइड। से लिया गया: pubchem.ncbi.nlm.nih.gov
- रियो टिंटो। (2019)। बोरिक्स ऑक्साइड। 20 खच्चर टीम बोरेक्स। से लिया गया: borax.com
- ए। मुखानोव, ओ। ओ। कुरकेविच, और वी। एल। सोलोजेनको। (एन.डी.)। बोरान (तृतीय) ऑक्साइड की कठोरता पर। LPMTMCNRS, यूनिवर्सिटि पेरिस नॉर्ड, विल्टानेस, फ्रांस.
- हेन्सन टी। (2015)। बी2हे3 (बोरिक ऑक्साइड)। से लिया गया: digitalfire.com


