इलेक्ट्रॉनों के समुद्र के सिद्धांत, गुण और नुकसान
इलेक्ट्रॉनों का इलेक्ट्रॉन सिद्धांत यह एक परिकल्पना है जो एक असाधारण रासायनिक घटना की व्याख्या करता है जो निम्न इलेक्ट्रोनगैटिविटी वाले तत्वों के बीच धातु के बंधन में होता है। यह धातु बांड द्वारा जुड़े विभिन्न परमाणुओं के बीच इलेक्ट्रॉनों के बंटवारे के बारे में है.
इन लिंक के बीच इलेक्ट्रॉनिक घनत्व ऐसा होता है कि इलेक्ट्रॉनों को सीमांकित किया जाता है और एक "समुद्र" बनाते हैं जहां वे स्वतंत्र रूप से चलते हैं। यह क्वांटम यांत्रिकी द्वारा भी व्यक्त किया जा सकता है: कुछ इलेक्ट्रॉनों (आमतौर पर एक से सात प्रति परमाणु) को कई केंद्रों के साथ कक्षा में व्यवस्थित किया जाता है जो धातु की सतह पर फैले होते हैं.
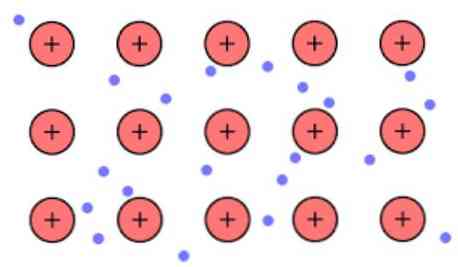
इसके अलावा, इलेक्ट्रॉन धातु में कुछ स्थान को बनाए रखते हैं, हालांकि कुछ विशिष्ट परमाणुओं के आसपास इलेक्ट्रॉनिक क्लाउड के वितरण की संभावना अधिक होती है। यह इस तथ्य के कारण है कि एक निश्चित वर्तमान को लागू करते समय वे एक विशिष्ट दिशा में अपनी चालकता दिखाते हैं.
सूची
- 1 इलेक्ट्रॉनों के समुद्र के सिद्धांत के मूल तत्व
- 2 गुण
- 2.1 परतों के रूप में ऑफसेट
- 2.2 धात्विक क्रिस्टल में इलेक्ट्रॉनों के समुद्र का सिद्धांत
- 3 सिद्धांत के नुकसान
- 4 संदर्भ
इलेक्ट्रॉनों के समुद्र के सिद्धांत के मूल तत्व
धातु तत्वों में अपने अंतिम ऊर्जा स्तर (वैलेंस लेयर) से इलेक्ट्रॉनों को दान करने की एक महान प्रवृत्ति होती है, जो अन्य तत्वों के संबंध में उनकी आयनीकरण ऊर्जा के कारण कम होती है.
यह जानने के बाद, प्रत्येक धात्विक तत्व को अपने अंतिम ऊर्जा स्तर के इलेक्ट्रॉन से जुड़ा हुआ एक धनायन माना जा सकता है, जिसे दान करने की संभावना अधिक होगी.
जैसे एक धातु में आपके पास बड़ी संख्या में परमाणु होते हैं जो एक साथ जुड़े होते हैं, आप मान सकते हैं कि यह धातु धातु के पिंजरों का एक समूह बनाता है जो एक प्रकार के समुद्र के इलेक्ट्रॉनों में डूबे होते हैं जिनमें एक बड़ा वंश होता है.
यह देखते हुए कि इलेक्ट्रोस्टैटिक आकर्षण बल जो कि धनायन (धनात्मक आवेश) और इलेक्ट्रॉन (ऋणात्मक आवेश) के बीच मौजूद हैं, में धातु के परमाणुओं को दृढ़ता से जोड़ा जाता है, यह वैद्युत इलेक्ट्रॉनों के निरूपण की कल्पना करता है जो इलेक्ट्रोस्टैटिक चिपकने के रूप में व्यवहार करता है: धातु cations के लिए.
इस तरह, यह अनुमान लगाया जा सकता है कि किसी धातु की वैलेंस परत में मौजूद इलेक्ट्रॉनों की संख्या जितनी अधिक होगी, इस तरह के इलेक्ट्रोस्टैटिक चिपकने से अधिक ताकत होगी.
गुण
इलेक्ट्रॉनों के समुद्र का सिद्धांत धातु की प्रजातियों की विशेषताओं, जैसे कि प्रतिरोधकता, चालकता, नमनीयता और अस्वच्छता के बारे में एक सरल व्याख्या प्रदान करता है, जो एक धातु से दूसरी धातु में भिन्न होती है.
यह पता चला है कि धातुओं को प्रदत्त प्रतिरोध उनके इलेक्ट्रॉनों के महान विलयन के कारण होता है, जो इसे बनाने वाले परमाणुओं के बीच एक बहुत उच्च सामंजस्य बल उत्पन्न करता है.
इस प्रकार, लचीलापन को कुछ सामग्रियों की क्षमता के रूप में जाना जाता है, जो उनकी संरचना की विकृति की अनुमति देता है, बिना टूटने के लिए पर्याप्त उपज के बिना, जब कुछ बलों के अधीन होते हैं।.
परतों के रूप में ऑफशोरिंग
किसी धातु की नमनीयता और अस्वाभाविकता दोनों इस तथ्य से निर्धारित होती है कि परतों के रूप में वैलेंस इलेक्ट्रॉनों को सभी दिशाओं में मुखर किया जाता है, जिसके कारण वे बाहरी बल की कार्रवाई के तहत एक-दूसरे के शीर्ष पर चले जाते हैं, धातु संरचना के टूटने से बचना लेकिन इसकी विकृति की अनुमति देना.
इसी तरह, इलेक्ट्रॉनों के आवागमन की स्वतंत्रता से विद्युत प्रवाह का प्रवाह होता है, जिससे धातुओं में बिजली की चालकता बहुत अच्छी होती है.
इसके अलावा, इलेक्ट्रॉनों की मुक्त गति की यह घटना धातु के विभिन्न क्षेत्रों के बीच गतिज ऊर्जा के हस्तांतरण की अनुमति देती है, जो गर्मी के संचरण को बढ़ावा देती है और धातुओं को एक उच्च तापीय चालकता प्रकट करने का कारण बनती है.
धात्विक क्रिस्टल में इलेक्ट्रॉनों के समुद्र का सिद्धांत
क्रिस्टल ठोस पदार्थ होते हैं जिनमें भौतिक और रासायनिक गुण होते हैं - जैसे कि घनत्व, गलनांक और कठोरता - यह उस प्रकार की शक्तियों द्वारा स्थापित होता है जो कणों को बनाते हैं जो उन्हें एक साथ रहते हैं.
एक तरह से, यह माना जाता है कि धातु प्रकार के क्रिस्टल में सबसे सरल संरचनाएं होती हैं, क्योंकि क्रिस्टल नेटवर्क के प्रत्येक "बिंदु" पर धातु के एक परमाणु द्वारा कब्जा कर लिया गया है।.
इसी अर्थ में, यह निर्धारित किया गया है कि आम तौर पर धातु क्रिस्टल की संरचना घन होती है और चेहरे या शरीर पर केंद्रित होती है.
हालांकि, ये प्रजातियां आकार में हेक्सागोनल भी हो सकती हैं और एक काफी कॉम्पैक्ट पैकिंग होती हैं, जो उन्हें भारी घनत्व देता है जो कि विशेषता है.
इस संरचनात्मक कारण के कारण, धातु के क्रिस्टल में जो बॉन्ड बनते हैं, वे उन लोगों से अलग होते हैं जो अन्य प्रकार के क्रिस्टल में होते हैं। इलेक्ट्रॉनों कि बांड बना सकते हैं क्रिस्टलीय संरचना भर में delocalised हैं, जैसा कि ऊपर बताया गया है.
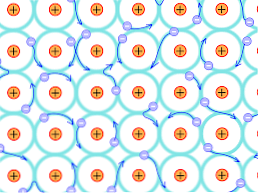
सिद्धांत का नुकसान
धातु परमाणुओं में उनके ऊर्जावान स्तरों के अनुपात में थोड़ी मात्रा में वैलेंस इलेक्ट्रॉनों होते हैं; अर्थात्, इलेक्ट्रॉनों की मात्रा की तुलना में उपलब्ध ऊर्जा राज्यों की एक बड़ी मात्रा है.
इसका तात्पर्य यह है कि, चूंकि एक मजबूत इलेक्ट्रॉनिक निरूपण है और साथ ही ऊर्जा बैंड जो आंशिक रूप से भरे हुए हैं, इलेक्ट्रॉनों को जालीदार संरचना के माध्यम से स्थानांतरित किया जा सकता है जब वे इलेक्ट्रॉन के महासागर बनाने के अलावा, बाहर से आने वाले एक विद्युत क्षेत्र के अधीन होते हैं। जो नेटवर्क की पारगम्यता का समर्थन करता है.
इसलिए धातुओं के मिलन की व्याख्या इलेक्ट्रॉनों के समुद्र द्वारा युग्मित धनात्मक आवेशित आयनों के समूह के रूप में की जाती है (नकारात्मक रूप से).
हालांकि, ऐसी विशेषताएं हैं जो इस मॉडल द्वारा नहीं बताई गई हैं, जैसे विशिष्ट रचनाओं के साथ धातुओं के बीच कुछ मिश्र धातुओं का निर्माण या सामूहिक धातु लिंक की स्थिरता, अन्य।.
इन कमियों को क्वांटम यांत्रिकी द्वारा समझाया गया है, क्योंकि यह सिद्धांत और कई अन्य दृष्टिकोण एकल इलेक्ट्रॉन के सबसे सरल मॉडल के आधार पर स्थापित किए गए हैं, जबकि मल्टीलेरोनिक परमाणुओं के बहुत अधिक जटिल संरचनाओं को लागू करने की कोशिश कर रहे हैं.
संदर्भ
- विकिपीडिया। (2018)। विकिपीडिया। En.wikipedia.org से लिया गया
- होल्मन, जे.एस., और स्टोन, पी। (2001)। रसायन विज्ञान। Books.google.co.ve से लिया गया
- पार्किन, जी। (2010)। धातु-धातु का संबंध। Books.google.co.ve से लिया गया
- रोहर, जी.एस. (2001)। क्रिस्टलीय सामग्री में संरचना और संबंध। Books.google.co.ve से लिया गया
- Ibach, H., और Lüth, H. (2009)। ठोस-राज्य भौतिकी: सामग्री विज्ञान के सिद्धांतों का परिचय। Books.google.co.ve से लिया गया


