आयरन सल्फाइड (II) गुण, जोखिम और उपयोग
आयरन सल्फाइड (II), जिसे फेरस सल्फाइड भी कहा जाता है, सूत्र FeS का एक रासायनिक यौगिक है। आयरन सल्फाइड पाउडर पायरोफोरिक है (यह हवा में अनायास जलता है).
सल्फाइड लोहा (II) प्रतिक्रिया के अनुसार सल्फर और लोहे को गर्म करके प्राप्त किया जाता है:
Fe + S → FeS
प्रतिक्रिया बहुत ही एक्ज़ोथिर्मिक है (गर्मी को छोड़ती है) और लोहे और सल्फर के बीच का अनुपात 7: 4 (NileRed, 2014) होना चाहिए.
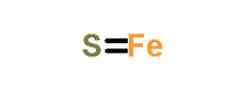
आयनिक लोहे (II) के घोल में सल्फर को घोलकर जलीय माध्यम में फेरस सल्फाइड भी प्राप्त किया जा सकता है। सल्फर के घुलने पर हाइड्रोजन सल्फाइड बनता है जो प्रतिक्रिया के अनुसार लोहे (II) के आयनों के साथ विपरीत प्रतिक्रिया करता है
धर्म2+ + एच2एस FeS (s) + 2 एच+
हालांकि, यह प्रतिक्रिया निम्न प्रकार से लोहे (II) एसिड सल्फेट के गठन की प्रतिक्रिया के साथ प्रतिस्पर्धा करती है:
धर्म2+ + 2HS- → Fe (HS)2(एस)
इसके बाद लौह (II) एसिड सल्फेट को फेरस सल्फेट के साथ विघटित किया जाता है, हालांकि प्रतिक्रिया बहुत धीरे-धीरे होती है (रिकार्ड, 1995).
सूची
- 1 भौतिक और रासायनिक गुण
- 2 प्रतिक्रिया और खतरों
- 3 हैंडलिंग और भंडारण
- 4 उपयोग
- 5 संदर्भ
भौतिक और रासायनिक गुण
आयरन (II) सल्फाइड एक गहरे भूरे या काले रंग का धातु-दिखने वाला ठोस होता है। जब यह शुद्ध होता है तो यह बेरंग होता है (नेशनल सेंटर फॉर बायोटेक्नोलॉजी इन्फॉर्मेशन, एस.एफ.)। चित्र 2 फेरस सल्फाइड की उपस्थिति को दर्शाता है.

यौगिक का आणविक भार 87.910 g / mol और घनत्व 4.84 g / ml है। इसका गलनांक 1195 ° C होता है और यह पानी और नाइट्रिक एसिड में अघुलनशील होता है (Royal Society of Chemistry, 2015).
फेरस ऑक्साइड और हाइड्रोजन सल्फाइड वाष्प बनाने के लिए अम्लीय माध्यम में फेरस सल्फाइड प्रतिक्रिया करता है जो अत्यंत विषैले होते हैं। यह निम्नलिखित प्रतिक्रिया में मनाया जाता है:
FeS + 2H+ → आस्था2+ + एच2एस
प्रतिक्रिया के अनुसार फेरस ऑक्साइड, सल्फर डाइऑक्साइड और पानी बनाने के लिए सल्फ्यूरिक एसिड के पतला समाधान के साथ प्रतिक्रियाएं:
FeS + एच2दप4 → फेओ + एच2ओ + एसओ2
प्रतिक्रिया और खतरों
फेरस सल्फाइड एक अस्थिर यौगिक है और हवा के साथ फेरस ऑक्साइड और सल्फर बनाता है। यौगिक पायरोफोरिक है और सहज प्रभाव से या एक मजबूत प्रभाव के उत्पाद को भी प्रज्वलित कर सकता है, इसलिए इसे संश्लेषित किए जाने पर मोर्टार में पीसना उचित नहीं है और देखभाल के साथ इलाज किया जाना चाहिए.
ऑक्सीकरण एजेंटों के साथ प्रतिक्रियाएं और जब गर्म अपघटन सल्फर ऑक्साइड के विषाक्त वाष्प का उत्सर्जन करता है। निगलना और आंखों के संपर्क में आने (इनहेरिटेंट) और इनहेलेशन (मटेरियल सेफ्टी डाटा शीट फेरस सल्फाइड, 2013) के मामले में यह यौगिक बहुत खतरनाक है।.
आंखों के संपर्क के मामले में, कम से कम 15 मिनट के लिए बहुत सारे पानी से धोया जाना चाहिए, कभी-कभी ऊपरी और निचले पलकें उठाना.
यदि यौगिक त्वचा के संपर्क में आता है, तो इसे दूषित कपड़ों और जूतों को हटाते समय कम से कम 15 मिनट तक भरपूर पानी से धोया जाना चाहिए।.
घूस के मामले में, यदि पीड़ित जागरूक और सतर्क है, तो उसे 2-4 कप दूध या पानी दिया जाना चाहिए। बेहोश व्यक्ति को कभी भी मुंह से कुछ न दें
साँस लेना के मामले में, पीड़ित को एक्सपोज़र के स्थान से हटा दिया जाना चाहिए और एक ठंडी जगह पर ले जाना चाहिए। यदि यह साँस नहीं लेता है, तो कृत्रिम श्वसन को प्रशासित किया जाना चाहिए। यदि साँस लेना मुश्किल है, तो ऑक्सीजन प्रशासित किया जाना चाहिए.
सभी मामलों में, तत्काल चिकित्सा ध्यान दिया जाना चाहिए (फिशर वैज्ञानिक, 2009).
आयरन सल्फाइड एक दुर्लभ सौम्य स्थिति में शामिल है जिसे स्यूडोमेलानोसिस डुओडेनी के रूप में जाना जाता है। यह ग्रहणी श्लेष्म में असतत, सपाट, काले-भूरे रंग के धब्बों के रूप में प्रकट होता है.
यह लक्षण पैदा नहीं करता है और प्रतिवर्ती हो सकता है। इलेक्ट्रॉन जांच द्वारा ऊर्जा फैलाव के इलेक्ट्रॉन माइक्रोस्कोपी और एक्स-रे विश्लेषण के साथ, वर्णक मुख्य रूप से लामिना प्रोप्रिया (चेंग सीएल, 2000) के भीतर मैक्रोफेज में फेरस सल्फाइड (FeS) के संचय से मेल खाती है.
हैंडलिंग और भंडारण
लौह सल्फाइड को गर्मी और इग्निशन के स्रोतों से दूर रखा जाना चाहिए। खाली कंटेनर एक आग जोखिम का प्रतिनिधित्व करते हैं, कचरे को एक चिमटा हुड के तहत वाष्पित किया जाना चाहिए। बिजली के स्पार्क से बचने के लिए सभी उपकरण युक्त सामग्री को ग्राउंड करें.
धूल में सांस न लें। आंखों के संपर्क से बचें। उपयुक्त सुरक्षात्मक कपड़े पहनें। अपर्याप्त वेंटिलेशन के मामले में, उपयुक्त श्वसन उपकरण पहनें.
यदि आप ठीक महसूस नहीं करते हैं, तो आपको चिकित्सा ध्यान देना चाहिए और यथासंभव उत्पाद लेबल दिखाना चाहिए। यौगिक को ऑक्सीकरण एजेंटों और एसिड जैसे असंगत पदार्थों से दूर रखा जाना चाहिए.
यौगिक वाले कंटेनर को ठंडे स्थान पर सूखा रखा जाना चाहिए। और इसे हवादार स्थान पर हवादार स्थान पर बंद किया जाना चाहिए। दहनशील सामग्री को अत्यधिक गर्मी से और मजबूत ऑक्सीकरण एजेंटों से दूर संग्रहीत किया जाना चाहिए.
अनुप्रयोगों
लौह और सल्फाइड का उपयोग मिश्र धातु और स्टेनलेस स्टील उद्योगों में हाइड्रोजन के उत्सर्जन को नियंत्रित करने के लिए किया जाता है। लोहे और इस्पात उद्योग कार्बन सल्फाइड, मिश्र धातु और स्टेनलेस स्टील के स्टील के निर्माण में फिर से सल्फ्यूराइजिंग एजेंट के रूप में लोहे के सल्फाइड का उपयोग करता है.
यह स्टील कास्टिंग मशीन की क्षमता में सुधार करने के लिए एक अपमानजनक एजेंट के रूप में भी काम करता है, जो विभिन्न स्टील भागों के उत्पादन में उपयोग किया जाता है। कच्चे फॉस्फोरिक एसिड की शुद्धि में लौह सल्फाइड का उपयोग फॉस्फोरिक एसिड से भारी अशुद्धियों को दूर करने के लिए कम करने वाले एजेंट के रूप में किया जाता है।.
लौह सल्फाइड का एक और उपयोग निंदनीय लोहे के उत्पादन में होता है। लौह सिलिकॉन और फेरोमैंगनीज के साथ संयुक्त लौह सल्फाइड का उपयोग स्टील और लोहे की सल्फर सामग्री को बढ़ाने के लिए किया जाता है.
आयरन सल्फाइड का उपयोग हाइड्रोजन सल्फाइड गैस की तैयारी के लिए एक प्रयोगशाला रसायन के रूप में भी किया जाता है। हेयर डाई, पेंट, सिरेमिक, बोतलों और चश्मे में, लोहे के सल्फाइड का उपयोग रंजक के रूप में किया जाता है। इसका उपयोग स्नेहक में और निकास गैसों के उपचार में भी किया जाता है.
आयरन सल्फाइड का सल्फेट्स के साथ संगत उपयोग होता है। सल्फेट यौगिक पानी में घुलनशील होते हैं और पानी के उपचार में उपयोग किए जाते हैं। आयरन सल्फाइड का उपयोग धातु के कास्टिंग के उत्पादन में भी किया जाता है.
आयरन सल्फाइड खनिज पाइराइट है जो सोने जैसा दिखता है और इसे "मूर्ख का सोना" कहा जाता है। पाइराइट का उपयोग सल्फर और सल्फ्यूरिक एसिड के उत्पादन में किया जाता है और कोयला खनन में भी उपयोग किया जाता है (जैनसन एलएबीएस (इंडिया), एस.एफ.).
संदर्भ
- चेंग सीएल, ई। एक। (2000)। स्यूडोमेलैनोसिस डुओडेनी: केस रिपोर्ट। चांगगेंग यी ज़ू ज़ी 23 (6), 372-376.
- वैज्ञानिक फिशर (2009, 20 अगस्त)। सामग्री सुरक्षा डेटा शीट आयरन (II) सल्फाइड। लेसेका से लिया गया.
- जैन्सन लैब (भारत)। (S.F.)। फेरस सल्फाइड के उपयोग। जैनसेफ से लिया गया.
- सामग्री सुरक्षा डेटा शीट लौह सल्फाइड। (2013, 21 मई)। Sciencelab से लिया गया.
- जैव प्रौद्योगिकी सूचना के लिए राष्ट्रीय केंद्र। (S.F.)। पबकेम कम्पाउंड डेटाबेस; CID = 14828। PubChem से लिया गया.
- (2014, 15 मई)। आयरन (II) सल्फाइड (ठंडी प्रतिक्रिया) तैयार करना। Youtube से लिया गया.
- रिकार्ड, डी। (1995)। FeS वर्षा के काइनेटिक्स: भाग 1। प्रतिक्रिया तंत्रों का मुकाबला करना। जियोचिमिका एट कॉस्मोइमिका एक्टा वॉल्यूम 59, अंक 21, 4367-4379.
- रॉयल सोसाइटी ऑफ केमिस्ट्री। (2015)। आयरन (II) सल्फाइड। Chemspider से लिया गया: chemspider.com.


