एंडोथर्मिक प्रतिक्रिया की विशेषताएं, समीकरण और उदाहरण
एक एंडोथर्मिक प्रतिक्रिया वह है जो अपने परिवेश से ऊर्जा को अवशोषित करने के लिए गर्मी या विकिरण के रूप में लेना चाहिए। आम तौर पर, हालांकि हमेशा नहीं, उन्हें अपने वातावरण में तापमान में गिरावट से पहचाना जा सकता है; या इसके विपरीत, उन्हें गर्मी के स्रोत की आवश्यकता होती है, जैसे कि एक जलती हुई लौ द्वारा प्राप्त किया जाता है.
ऊर्जा या ऊष्मा का अवशोषण वह है जो सभी एंडोथर्मिक प्रतिक्रियाओं में आम है; उसी की प्रकृति, साथ ही साथ इसमें शामिल रूपांतरण, बहुत विविध हैं। उन्हें कितनी गर्मी अवशोषित करनी चाहिए? इसका उत्तर इसके ऊष्मागतिकी पर निर्भर करता है: जिस तापमान पर प्रतिक्रिया अनायास होती है.

उदाहरण के लिए, सबसे द्योतक एंडोथर्मिक प्रतिक्रियाओं में से एक बर्फ से तरल पानी तक राज्य का परिवर्तन है। बर्फ को गर्मी को अवशोषित करने की आवश्यकता होती है जब तक उसका तापमान लगभग 0 needsC तक नहीं पहुंच जाता; उस तापमान पर इसका पिघलना सहज हो जाता है, और बर्फ तब तक सोखता रहेगा जब तक वह पूरी तरह से पिघल नहीं जाता.
गर्म स्थानों में, जैसे कि समुद्र तट के किनारे पर, तापमान अधिक होता है और इसलिए बर्फ तेजी से गर्मी अवशोषित करती है; अर्थात् यह उच्च गति पर पिघलता है। ग्लेशियरों का पिघलना अवांछनीय एंडोथर्मिक प्रतिक्रिया का एक उदाहरण है.
ऐसा क्यों होता है? बर्फ को गर्म ठोस के रूप में क्यों नहीं प्रस्तुत किया जा सकता है? उत्तर दोनों राज्यों में पानी के अणुओं की औसत गतिज ऊर्जा में निहित है, और वे अपने हाइड्रोजन बांड के माध्यम से एक दूसरे के साथ कैसे बातचीत करते हैं.
तरल पानी में, इसके अणुओं में बर्फ की तुलना में आंदोलन की अधिक स्वतंत्रता होती है, जहां वे अपने क्रिस्टल में स्थिर कंपन करते हैं। स्थानांतरित करने के लिए, अणुओं को ऊर्जा को इस तरह से अवशोषित करना चाहिए कि उनका कंपन बर्फ में मजबूत दिशात्मक हाइड्रोजन पुलों को तोड़ दे.
इस कारण बर्फ पिघलने के लिए गर्मी को अवशोषित करती है। "गर्म बर्फ" होने के लिए हाइड्रोजन पुलों को 0 डिग्री सेल्सियस से ऊपर के तापमान पर पिघलने के लिए असामान्य रूप से मजबूत होना होगा।.
सूची
- 1 एक एंडोथर्मिक प्रतिक्रिया के लक्षण
- १.१ एचएच> ०
- 1.2 उनके परिवेश को ठंडा करें
- 2 समीकरण
- 3 सामान्य एंडोथर्मिक प्रतिक्रियाओं के उदाहरण
- 3.1 सूखी बर्फ का वाष्पीकरण
- 3.2 ब्रेड का पकाना या खाना पकाना
- ३.३ धूपं समर्पयामि
- 3.4 वायुमंडलीय नाइट्रोजन और ओजोन के गठन की प्रतिक्रिया
- 3.5 जल इलेक्ट्रोलिसिस
- 3.6 प्रकाश संश्लेषण
- ३. of कुछ लवण के घोल
- 3.8 तापीय विघटन
- पानी में 3.9 अमोनियम क्लोराइड
- 3.10 सोडियम ट्रायोसल्फेट
- 3.11 कार के इंजन
- 3.12 उबलते तरल पदार्थ
- 3.13 एक अंडा पकाना
- 3.14 खाना बनाना
- 3.15 माइक्रोवेव में खाना गर्म करना
- 3.16 ग्लास मोल्डिंग
- 3.17 एक मोमबत्ती की खपत
- 3.18 गर्म पानी से सफाई
- 3.19 भोजन और अन्य वस्तुओं की गर्मी नसबंदी
- 3.20 बुखार से लड़ना संक्रमण
- 3.21 पानी का वाष्पीकरण
- 4 संदर्भ
एक एंडोथर्मिक प्रतिक्रिया के लक्षण
राज्य का परिवर्तन ठीक से रासायनिक प्रतिक्रिया नहीं है; हालाँकि, एक ही बात होती है: उत्पाद (तरल पानी) में अभिकारक (बर्फ) की तुलना में अधिक ऊर्जा होती है। यह एक प्रतिक्रिया या एंडोथर्मिक प्रक्रिया की मुख्य विशेषता है: उत्पाद अभिकारकों की तुलना में अधिक ऊर्जावान हैं.
हालांकि यह सच है, इसका मतलब यह नहीं है कि उत्पादों को जरूरी अस्थिर होना चाहिए। इस मामले में कि यह है, एंडोथर्मिक प्रतिक्रिया तापमान या दबाव की सभी परिस्थितियों में सहज होती जा रही है.
निम्नलिखित रासायनिक समीकरण पर विचार करें:
ए + क्यू => बी
जहां Q ऊष्मा का प्रतिनिधित्व करता है, आमतौर पर जूल (J) या कैलोरी (कैल) की इकाइयों के साथ व्यक्त किया जाता है। चूँकि A ऊष्मा Q को B में बदलने को अवशोषित करता है, इसलिए यह कहा जाता है कि यह एक एंडोथर्मिक प्रतिक्रिया है। इस प्रकार, बी में ए की तुलना में अधिक ऊर्जा है, और इसके परिवर्तन को प्राप्त करने के लिए पर्याप्त ऊर्जा को अवशोषित करना चाहिए.
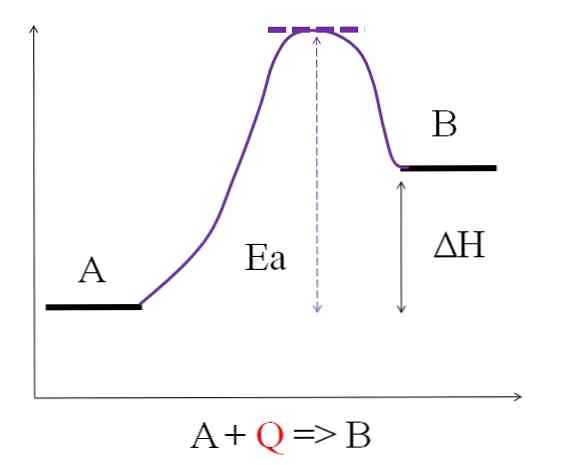
जैसा कि ऊपर चित्र में देखा जा सकता है, ए में बी से कम ऊर्जा है। गर्मी की मात्रा जो ए को अवशोषित करती है, वह ऐसी है कि यह सक्रियण ऊर्जा (बिंदीदार छत के साथ बैंगनी शीर्ष तक पहुंचने के लिए आवश्यक ऊर्जा) पर काबू पाती है। ए और बी के बीच ऊर्जा का अंतर वह है जो प्रतिक्रिया की थैली के रूप में जाना जाता है, andH.
0H> ०
सभी अंतर्गर्भाशयकला संबंधी प्रतिक्रियाएं पिछले चित्र में आम हैं, क्योंकि उत्पाद अभिकारकों की तुलना में अधिक ऊर्जावान हैं। इसलिए, उनके बीच ऊर्जा अंतर, betweenH, हमेशा सकारात्मक (एच) हैउत्पाद-एचअभिकर्मक > 0)। जब यह सच होता है, तो इस ऊर्जावान ज़रूरत को पूरा करने के लिए परिवेश से गर्मी या ऊर्जा का अवशोषण होना चाहिए.
और ऐसे भावों की व्याख्या कैसे की जाती है? एक रासायनिक प्रतिक्रिया में लिंक दूसरों को बनाने के लिए हमेशा टूट जाते हैं। उन्हें तोड़ने के लिए, ऊर्जा का अवशोषण आवश्यक है; अर्थात्, यह एक एंडोथर्मिक मार्ग है। इस बीच, लिंक का गठन स्थिरता का अर्थ है, इसलिए यह एक एक्ज़ोथिर्मिक कदम है.
जब बनाए गए बंधन पुराने बंधनों को तोड़ने के लिए आवश्यक ऊर्जा की मात्रा के बराबर स्थिरता प्रदान नहीं करते हैं, तो यह एक एंडोथर्मिक प्रतिक्रिया है। इसीलिए अभिकर्मकों में सबसे अधिक स्थिर बंधनों को तोड़ने को बढ़ावा देने के लिए अतिरिक्त ऊर्जा की आवश्यकता होती है.
दूसरी ओर, एक्सोथर्मिक प्रतिक्रियाओं में विपरीत होता है: गर्मी जारी होती है, और handH होती है < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
वे अपने परिवेश को ठंडा करते हैं
यद्यपि यह सभी एंडोथर्मिक प्रतिक्रियाओं पर लागू नहीं होता है, उनमें से कई इसके आसपास के तापमान में कमी का कारण बनते हैं। ऐसा इसलिए है क्योंकि अवशोषित गर्मी कहीं से आती है। नतीजतन, अगर ए और बी के रूपांतरण को कंटेनर में ले जाया जाता है, तो यह ठंडा हो जाएगा.
प्रतिक्रिया जितनी अधिक होगी, उतने ही ठंडे कंटेनर और उसके आसपास का वातावरण बन जाएगा। वास्तव में, कुछ प्रतिक्रियाएं एक पतली बर्फ आवरण बनाने में भी सक्षम हैं, जैसे कि वे एक रेफ्रिजरेटर से बाहर आए थे.
हालांकि, इस प्रकार की प्रतिक्रियाएं हैं जो अपने परिवेश को ठंडा नहीं करती हैं। क्यों? क्योंकि परिवेश की गर्मी अपर्याप्त है; यही है, यह आवश्यक क्यू (जे, सीएएल) प्रदान नहीं करता है जो रासायनिक समीकरणों में लिखा गया है। इसलिए, यह तब होता है जब आग या पराबैंगनी विकिरण प्रवेश करती है.
दोनों परिदृश्यों के बीच एक छोटा सा भ्रम पैदा हो सकता है। एक तरफ, परिवेश की गर्मी सहज प्रतिक्रिया के लिए प्रतिक्रिया करती है, और एक शीतलन मनाया जाता है; और दूसरे पर, अधिक गर्मी की आवश्यकता होती है और एक कुशल हीटिंग विधि का उपयोग किया जाता है। दोनों ही मामलों में एक ही बात होती है: ऊर्जा अवशोषित होती है.
समीकरण
एंडोथर्मिक प्रतिक्रिया में प्रासंगिक समीकरण क्या हैं? जैसा कि पहले ही समझाया गया है, ΔH सकारात्मक होना चाहिए। इसकी गणना करने के लिए, निम्नलिखित रासायनिक समीकरण को पहले माना जाता है:
एए + बीबी => सीसी + डीडी
जहां ए और बी प्रतिक्रियाशील पदार्थ हैं, और सी और डी उत्पाद हैं। लोअरकेस अक्षर (ए, बी, सी और डी) स्टोइकोमेट्रिक गुणांक हैं। इस सामान्य प्रतिक्रिया के calculateH की गणना करने के लिए निम्नलिखित गणितीय अभिव्यक्ति लागू होती है:
.DELTA.Hउत्पादन- .DELTA.Hअभिकर्मकों = ΔHrxn
आप सीधे आगे बढ़ सकते हैं, या अलग से गणना कर सकते हैं। ΔH के लिएउत्पादन निम्नलिखित राशि की गणना की जानी चाहिए:
c ΔHएफसी + डी + एचएफडी
कहां ΔHएफ यह प्रतिक्रिया में शामिल प्रत्येक पदार्थ के गठन की तापीय धारिता है। अधिवेशन द्वारा, पदार्थों को उनके सबसे स्थिर रूपों में substancesH हैएफ= 0 उदाहरण के लिए, हे अणु2 और एच2, या एक ठोस धातु, उनके पास theyH हैएफ= 0.
वही गणना अब अभिकारकों के लिए की जाती है, doneHअभिकर्मकों:
से ΔH तकएफए + बी Δ एचएफबी
लेकिन जैसा कि समीकरण कहता है कि thatHअभिकर्मकों .H से घटाया जाना चाहिएउत्पादन, फिर पिछली राशि को -1 से गुणा किया जाना चाहिए। तो आपके पास है:
c ΔHएफसी + डी + एचएफडी - (से ΔHएफए + बी Δ एचएफबी)
यदि इस गणना का परिणाम एक सकारात्मक संख्या है, तो यह एक एंडोथर्मिक प्रतिक्रिया है। और अगर यह नकारात्मक है, तो यह एक एक्ज़ोथिर्मिक प्रतिक्रिया है.
सामान्य एंडोथर्मिक प्रतिक्रियाओं के उदाहरण
सूखी बर्फ का वाष्पीकरण

जिसने भी उन सफेद वाष्पों को आइसक्रीम की गाड़ी से निकलते देखा है, उसने एक एंडोथर्मिक प्रतिक्रिया के सबसे सामान्य उदाहरणों में से एक देखा है ".
कुछ बर्फ की क्रीमों से परे, ठोस सफेद से अलग किए गए इन वाष्पों को सूखी बर्फ कहा जाता है, जो धुंध के प्रभाव को बनाने के लिए परिदृश्यों का हिस्सा भी रहे हैं। यह सूखी बर्फ ठोस कार्बन डाइऑक्साइड से अधिक कुछ नहीं है, जो तापमान को अवशोषित करती है और बाहरी दबाव से पहले जलमग्न होने लगती है.
एक बच्चे के दर्शकों के लिए एक प्रयोग सूखी बर्फ के साथ एक बैग को भरना और सील करना होगा। थोड़ी देर के बाद, यह सीओ की वजह से फुलाएगी2 गैसीय, जो काम पैदा करता है या वायुमंडलीय दबाव के खिलाफ बैग की आंतरिक दीवारों को दबाता है.
रोटियां सेंकना या खाना पकाना

ब्रेड की बेकिंग एक रासायनिक प्रतिक्रिया का एक उदाहरण है, क्योंकि अब गर्मी के कारण रासायनिक परिवर्तन होते हैं। जो कोई भी ताजा बेक्ड ब्रेड की सुगंध को सूंघता है वह जानता है कि एक एंडोथर्मिक प्रतिक्रिया हो रही है.
आटा और इसकी सभी सामग्री, सभी परिवर्तनों को पूरा करने के लिए ओवन की गर्मी की जरूरत है, रोटी बनने के लिए अपरिहार्य और इसकी विशिष्ट विशेषताओं का प्रदर्शन.
ब्रेड के अलावा, रसोई एंडोथर्मिक प्रतिक्रियाओं के उदाहरणों से भरा है। कौन रोज उनके साथ खाना बनाता है। खाना बनाना पास्ता, अनाज को नरम करना, मकई के दानों को गर्म करना, अंडे को पकाना, मीट को पकाना, एक केक को पकाना, चाय बनाना, सैंडविच को गर्म करना; इन गतिविधियों में से प्रत्येक एंडोथर्मिक प्रतिक्रियाएं हैं.
धूप सेंकने

जैसा कि वे सरल और सामान्य लग सकते हैं, कुछ सहायक सरीसृप, जैसे कछुए और मगरमच्छ, सनबाथ, एंडोथर्मिक प्रतिक्रियाओं की श्रेणी में आते हैं। कछुए अपने जीव के तापमान को विनियमित करने के लिए सूर्य से गर्मी को अवशोषित करते हैं.
सूरज के बिना, वे गर्म रखने के लिए पानी की गर्मी को बरकरार रखते हैं; क्या आपके टैंक या मछली के टैंक में पानी ठंडा होता है.
वायुमंडलीय नाइट्रोजन और ओजोन के गठन की प्रतिक्रिया

वायु मुख्य रूप से नाइट्रोजन और ऑक्सीजन से बनी होती है। गरज के दौरान, एक ऊर्जा जारी की जाती है जो एन-अणु में नाइट्रोजन परमाणुओं को एक साथ रखने वाले मजबूत बंधन को तोड़ सकती है।2:
एन2 + हे2 + क्यू => 2NO
दूसरी ओर, ऑक्सीजन ओजोन बनने के लिए पराबैंगनी विकिरण को अवशोषित कर सकता है; ऑक्सीजन का आवंटन जो समताप मंडल में बहुत फायदेमंद है, लेकिन जमीनी स्तर पर जीवन के लिए हानिकारक है। प्रतिक्रिया है:
3O2 + v => 2O3
जहाँ v का अर्थ पराबैंगनी विकिरण है। उस सरल समीकरण के पीछे का तंत्र बहुत जटिल है.
पानी की इलेक्ट्रोलिसिस
इलेक्ट्रोलिसिस अपने तत्वों में अणु बनाने या अणुओं को अलग करने के लिए विद्युत ऊर्जा का उपयोग करता है। उदाहरण के लिए, पानी के इलेक्ट्रोलिसिस में दो गैसें उत्पन्न होती हैं: हाइड्रोजन और ऑक्सीजन, प्रत्येक अलग-अलग इलेक्ट्रोड में:
2H2ओ => २ एच2 + हे2
इसके अलावा, सोडियम क्लोराइड भी इसी प्रतिक्रिया को झेल सकता है:
2NaCl => 2Na + Cl2
एक इलेक्ट्रोड में आप धातु सोडियम का गठन देखेंगे, और दूसरे में क्लोरीन के हरे रंग के बुलबुले.
प्रकाश संश्लेषण

पौधों और पेड़ों को अपने बायोमेट्रिक को संश्लेषित करने के लिए ऊर्जा की आपूर्ति के रूप में सूर्य के प्रकाश को अवशोषित करने की आवश्यकता होती है। इसके लिए, यह कच्चे माल के रूप में सीओ का उपयोग करता है2 और पानी, जो चरणों की एक लंबी श्रृंखला के माध्यम से ग्लूकोज और अन्य शर्करा में परिवर्तित हो जाता है। इसके अलावा, ऑक्सीजन का निर्माण होता है, जो पत्तियों से निकलता है.
कुछ लवण के समाधान
यदि सोडियम क्लोराइड को पानी में घोल दिया जाता है, तो बर्तन या कंटेनर के बाहरी तापमान में कोई उल्लेखनीय परिवर्तन नहीं देखा जाएगा।.
कुछ लवण, जैसे कि कैल्शियम क्लोराइड, CaCl2, सीए आयन के महान जलयोजन के उत्पाद के रूप में पानी का तापमान बढ़ाएं2+. और अन्य लवण, जैसे नाइट्रेट या अमोनियम क्लोराइड, एनएच4नहीं3 और एनएच4सीएल, पानी के तापमान को कम करने और उसके आसपास ठंडा.
कक्षाओं में आमतौर पर घर के बनाये हुए प्रयोग इन लवणों को घोलने के लिए किए जाते हैं, जो कि एक एंडोथर्मिक प्रतिक्रिया है.
तापमान में कमी एनएच आयनों के जलयोजन के कारण है4+ यह अपने लवण की क्रिस्टलीय व्यवस्था के विघटन के पक्षधर नहीं हैं। नतीजतन, नमक पानी से गर्मी को अवशोषित करते हैं ताकि आयनों को सॉल्व किया जा सके.
एक और रासायनिक प्रतिक्रिया है जो आमतौर पर यह प्रदर्शित करने के लिए बहुत आम है निम्नलिखित है:
बा (OH)2· 8 एच2ओ + 2 एन एच4नहीं3 => बा (सं।)3)2 + 2NH3 +10H2हे
पानी की मात्रा पर ध्यान दें। दोनों ठोसों को मिलाकर एक जलीय बा विलयन प्राप्त किया जाता है (NO3)2, अमोनिया की गंध के साथ, और इस तरह के तापमान में गिरावट के साथ जो सचमुच कंटेनर की बाहरी सतह को जमा देता है.
तापीय विघटन
सबसे आम थर्मल डिकम्पोजिशन में से एक सोडियम बाइकार्बोनेट, NaHCO है3, सीओ का उत्पादन करने के लिए2 और पानी गरम होने पर। कार्बोनेट सहित कई ठोस, सीओ जारी करने के लिए विघटित होते हैं2 और इसी ऑक्साइड। उदाहरण के लिए, कैल्शियम कार्बोनेट का अपघटन इस प्रकार है:
CaCO3 + क्यू => सीएओ + सीओ2
ऐसा ही मैग्नीशियम, स्ट्रोंटियम और बेरियम कार्बोनेट के साथ होता है.
यह ध्यान रखना महत्वपूर्ण है कि एक थर्मल अपघटन एक दहन से अलग है। पहले में प्रज्वलन की कोई उपस्थिति नहीं है या गर्मी जारी है, जबकि दूसरे में हाँ; यह है, दहन एक अतिसक्रिय प्रतिक्रिया है, भले ही यह जगह लेने या अनायास होने के लिए गर्मी के प्रारंभिक स्रोत की आवश्यकता हो.
पानी में अमोनियम क्लोराइड
जब एक परखनली में थोड़ी मात्रा में अमोनियम क्लोराइड (NH4Cl) पानी में घुल जाता है, तो ट्यूब पहले की तुलना में ठंडा हो जाता है। इस रासायनिक प्रतिक्रिया के दौरान, गर्मी पर्यावरण से अवशोषित होती है.
सोडियम ट्रायोसल्फेट
जब सोडियम थायोसल्फेट क्रिस्टल (ना)2एस2हे3.5H2ओ), जिसे आमतौर पर हाइपो कहा जाता है, पानी में घुल जाता है, एक शीतलन प्रभाव होता है.
कार का इंजन
कारों, ट्रकों, ट्रैक्टरों या बसों के इंजन में गैसोलीन या डीजल के जलने से यांत्रिक ऊर्जा उत्पन्न होती है, जिसका उपयोग इन वाहनों के प्रचलन में किया जाता है.
उबलते तरल पदार्थ
गर्मी में एक तरल डालकर, यह ऊर्जा प्राप्त करता है और गैसीय अवस्था में चला जाता है.
एक अंडा पकाना
जब गर्मी लगाई जाती है, तो अंडे के प्रोटीन को ठोस संरचना के रूप में दर्शाया जाता है जो आमतौर पर घिस जाता है.
खाना बनाना
सामान्य तौर पर, हमेशा भोजन के गुणों को बदलने के लिए गर्मी के साथ खाना पकाने पर, एंडोथर्मिक प्रतिक्रियाएं होती हैं.
ये प्रतिक्रियाएं किस कारण से भोजन को नरम बनाती हैं, निंदनीय द्रव्यमान उत्पन्न करती हैं, उन घटकों को छोड़ती हैं जिनमें वे शामिल हैं, अन्य चीजों के बीच.
माइक्रोवेव में खाना गर्म करना
माइक्रोवेव विकिरण से, भोजन में पानी के अणु ऊर्जा को अवशोषित करते हैं, भोजन के तापमान को कंपन और बढ़ाना शुरू करते हैं.
ढाला हुआ गिलास
ग्लास द्वारा गर्मी का अवशोषण उनके जोड़ों को अधिक लचीला बनाता है, जिससे उनका आकार बदलने में आसानी होती है.
एक मोमबत्ती की खपत
मोमबत्ती का मोम पिघलता है क्योंकि यह लौ की गर्मी को अवशोषित करता है, जिससे इसका आकार बदल जाता है.
गर्म पानी से सफाई
जब गर्म पानी का उपयोग वस्तुओं को साफ करने के लिए किया जाता है, जैसे कि बर्तन या कपड़े, तो तेल अधिक तरल हो जाता है और निकालना आसान होता है.
भोजन और अन्य वस्तुओं की गर्मी नसबंदी
वस्तुओं या भोजन को गर्म करते समय, जिन सूक्ष्मजीवों में वे होते हैं, उनका तापमान भी बढ़ता है.
जब बहुत अधिक गर्मी की आपूर्ति की जाती है, तो माइक्रोबियल कोशिकाओं के अंदर प्रतिक्रियाएं होती हैं। इन प्रतिक्रियाओं में से कई, जैसे कि बंधन या प्रोटीन विकृतीकरण, अंत में सूक्ष्मजीवों को मारते हैं.
बुखार के साथ संक्रमण से लड़ना
जब बुखार स्वयं प्रकट होता है, तो यह इसलिए होता है क्योंकि शरीर बैक्टीरिया और वायरस को मारने के लिए आवश्यक गर्मी पैदा करता है जो संक्रमण पैदा करते हैं और बीमारियां पैदा करते हैं.
यदि गर्मी उत्पन्न होती है और बुखार अधिक होता है, तो शरीर की कोशिकाएं भी प्रभावित होती हैं और मृत्यु का खतरा होता है.
पानी का वाष्पीकरण
जब पानी वाष्पित होता है और भाप में परिवर्तित होता है, तो यह वातावरण से प्राप्त होने वाली गर्मी के कारण होता है। चूंकि थर्मल ऊर्जा पानी के प्रत्येक अणु द्वारा प्राप्त की जाती है, इसकी कंपन ऊर्जा उस बिंदु तक बढ़ जाती है जहां यह स्वतंत्र रूप से आगे बढ़ सकती है, जिससे वाष्प का निर्माण होता है.
संदर्भ
- Whitten, डेविस, पेक और स्टेनली। (2008)। रसायन विज्ञान। (8 वां संस्करण।) CENGAGE लर्निंग.
- विकिपीडिया। (2018)। एंडोथर्मिक प्रक्रिया। से लिया गया: en.wikipedia.org
- हेलमेनस्टाइन, ऐनी मैरी, पीएच.डी. (27 दिसंबर, 2018)। एंडोथर्मिक रिएक्शन उदाहरण। से लिया गया: सोचाco.com
- खान अकादमी। (2019)। एंडोथेरमिक बनाम एक्ज़ोथिर्मिक प्रतिक्रियाएँ से लिया गया: khanacademy.org
- सरम मर्सन। (2019)। एक एंडोथर्मिक रिएक्शन के दौरान आणविक स्तर पर क्या होता है? हर्स्ट सिएटल मीडिया। से लिया गया: education.seattlepi.com
- QuimiTube। (2013)। गठन की थैलपियों से थैलेपी की प्रतिक्रिया की गणना। से लिया गया: quimitube.com
- Quimicas.net (2018)। एंडोथर्मिक रिएक्शन के उदाहरण। से लिया गया:
quimicas.net.


