मैग्नीशियम हाइड्राइड सूत्र, रासायनिक संरचना और गुण
मैग्नीशियम हाइड्राइड (MGH2 आणविक सूत्र), 7.66% हाइड्रोजन के वजन में सामग्री के साथ एक रासायनिक यौगिक है, और प्रकृति में एक सफेद क्रिस्टलीय ठोस के रूप में पाया जाता है। इसका उपयोग मुख्य रूप से अन्य रासायनिक पदार्थों को तैयार करने के लिए किया जाता है, हालांकि यह हाइड्रोजन के लिए संभावित भंडारण माध्यम के रूप में भी अध्ययन किया गया है.
यह खारा (या आयनिक) हाइड्राइड्स के परिवार से संबंधित है, जो एच-आयन द्वारा नकारात्मक रूप से चार्ज किए गए परिभाषित हैं। इन हाइड्राइड को उन माना जाता है जो क्षारीय धातुओं और क्षारीय पृथ्वी धातुओं से बनते हैं, लेकिन मैग्नीशियम (और बेरिलियम) के मामले में सहसंयोजक बंधन होते हैं, उन आयनों के अलावा जो हाइड्राइड के इस परिवार की विशेषता रखते हैं.
सूची
- 1 तैयारी और सूत्र
- 2 रासायनिक संरचना
- 3 भौतिक और रासायनिक गुण
- ३.१ शारीरिक
- ३.२ रसायन
- 4 उपयोग
- 4.1 हाइड्रोजन भंडारण
- 4.2 हाइड्रोजनीकरण और डीहाइड्रोजनीकरण की प्रतिक्रियाएँ
- 4.3 कीचड़
- 4.4 ईंधन सेल
- ४.५ परिवहन और ऊर्जा
- ४.६ अलकाइलेशन
- 5 जोखिम
- 5.1 पानी के साथ प्रतिक्रिया
- 5.2 यह पायरोफोरिक है
- 6 संदर्भ
तैयारी और सूत्र
मैग्नीशियम हाइड्राइड मैग्नीशियम (Mg) धातु के प्रत्यक्ष हाइड्रोजनीकरण के माध्यम से एक MgI उत्प्रेरक के साथ उच्च दबाव और तापमान (200 वायुमंडल, 500 )C) की स्थितियों में बनता है।2. इसकी प्रतिक्रिया इसके बराबर है:
Mg + H2→ एमजीएच2
MgH के उत्पादन की भी जांच की गई है2 बॉल मिलों में उत्पादित नैनोक्रिस्टलाइन मैग्नीशियम के उपयोग के साथ कम तापमान पर.
तैयारी के अन्य तरीके भी हैं, लेकिन वे अधिक जटिल रासायनिक प्रतिक्रियाओं (मैग्नीशियम-एन्थ्रेसीन के हाइड्रोजनेशन, लिथियम-एल्यूमीनियम हाइड्राइड के साथ डायथाइलमैग्नेशियम के बीच प्रतिक्रिया और एक एमजीएच कॉम्प्लेक्स के उत्पाद के रूप में प्रतिनिधित्व करते हैं)2).
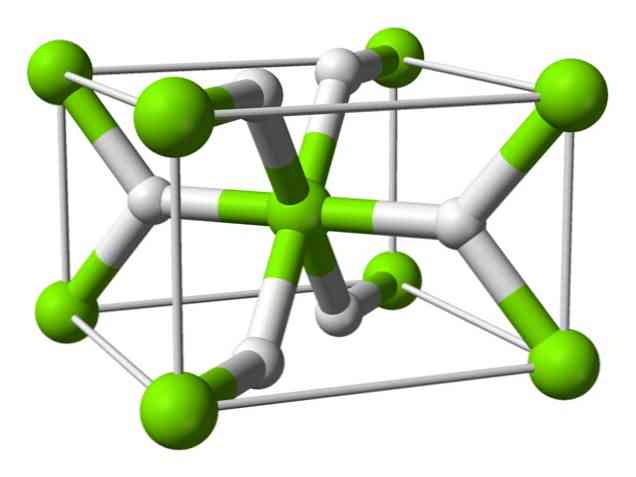
रासायनिक संरचना
इस परमाणु में कमरे के तापमान पर रूटाइल की संरचना होती है, जिसमें टेट्रागोनल क्रिस्टलीय संरचना होती है। उच्च दबाव की परिस्थितियों में इसके कम से कम चार अलग-अलग रूप हैं, और हाइड्रोजन की कमियों के साथ एक गैर-स्टोइकोमेट्रिक संरचना भी देखी गई है; उत्तरार्द्ध केवल कणों के बहुत कम मात्रा में बनने पर होता है.
जैसा कि ऊपर उल्लेख किया गया है, रुटाइल संरचना में मौजूद बॉन्ड में अन्य आयनित लवण हाइड्राइड की तरह विशुद्ध रूप से आयनिक होने के बजाय आंशिक रूप से सहसंयोजक गुण होते हैं।.
इससे मैग्नीशियम परमाणु का गोलाकार आकार होता है, पूरी तरह से आयनित होता है, लेकिन इसके हाइड्राइड आयन में एक लम्बी संरचना होती है.
भौतिक और रासायनिक गुण
भौतिक
- सूरत: सफेद क्रिस्टल.
- मोलर द्रव्यमान: 26.3209 ग्राम / मोल
- घनत्व: 1.45 ग्राम / सेमी3
- गलनांक: 285 ° C विघटित होता है
- घुलनशीलता: पानी में विघटित.
इस रासायनिक यौगिक का आणविक भार 26,321 g / mol है, जिसका घनत्व 1.45 g / cm3 है और इसका गलनांक 327 ° C है.
रासायनिक
- अन्य रासायनिक पदार्थों के निर्माण के लिए अग्रदूत.
- हाइड्रोजन भंडारण, ऊर्जा के संभावित स्रोत के रूप में.
- कार्बनिक संश्लेषण में एजेंट को कम करना.
यह इंगित करना महत्वपूर्ण है कि इस यौगिक को तरल अवस्था में नहीं लाया जा सकता है, और जब इसे ले जाया जाता है या इसके पिघलने बिंदु या पानी में पेश किया जाता है, तो यह विघटित हो जाता है। यह हाइड्राइड ईथर में अघुलनशील है.
यह एक अत्यधिक प्रतिक्रियाशील और अत्यधिक ज्वलनशील पदार्थ है, और पायरोफोरिक भी है, अर्थात यह हवा में अनायास ही प्रज्वलित हो सकता है। ये तीन स्थितियां सुरक्षा जोखिमों का प्रतिनिधित्व करती हैं जिनका उल्लेख इस लेख के अंतिम खंड में किया जाएगा.
अनुप्रयोगों
हाइड्रोजन का भंडारण
मैग्नीशियम हाइड्राइड हाइड्रोजन गैस बनाने के लिए पानी के साथ आसानी से प्रतिक्रिया करता है, निम्नलिखित रासायनिक प्रतिक्रिया के माध्यम से:
MGH2+2H2ओ → २ एच2+Mg (OH)2
इसके अलावा, यह पदार्थ 287 डिग्री सेल्सियस के तापमान पर और 1 बार के दबाव पर विघटित होता है, इस प्रकार है:
MGH2→ Mg + H2
इसलिए, इसके उपयोग और परिवहन के लिए हाइड्रोजन भंडारण माध्यम के रूप में मैग्नीशियम हाइड्राइड का उपयोग प्रस्तावित किया गया है.
धातु मैग्नीशियम की मात्रा के हाइड्रोजनीकरण और निर्जलीकरण को गैसीय हाइड्रोजन की मात्रा के परिवहन के एक तरीके के रूप में प्रस्तावित किया जाता है, इस प्रकार यह सुनिश्चित करना कि इसके परिवहन में कोई रिसाव नहीं है और उच्च दबाव वाले जहाजों के उपयोग की तुलना में सुरक्षित और अधिक व्यावहारिक तरीके का प्रतिनिधित्व करता है।.
हाइड्रोजनीकरण और निर्जलीकरण प्रतिक्रियाएँ
हालांकि मैग्नीशियम हाइड्राइड का अपघटन तापमान इसके उपयोग के लिए एक सीमित कारक का प्रतिनिधित्व करता है, तरीकों को हाइड्रोजनीकरण और निर्जलीकरण प्रतिक्रियाओं के कैनेटीक्स में सुधार करने का प्रस्ताव दिया गया है। इनमें से एक गेंद मिलों के उपयोग के साथ मैग्नीशियम कण के आकार में कमी के साथ है.
कीचड़
इसके अलावा, एक प्रणाली प्रस्तावित की गई है जो मिट्टी (पाउडर या अन्य ठोस कणों की तुलना में अधिक प्रबंधनीय और सुरक्षित) के रूप में मैग्नीशियम हाइड्राइड का उत्पादन करती है, जिसे वांछित हाइड्रोजन प्राप्त करने के लिए पानी के साथ प्रतिक्रिया होगी.
यह अनुमान लगाया जाता है कि पहले से तैयार कीचड़ एक पतले जमीन हाइड्राइड द्वारा बनाई जाएगी, तेलों की एक सुरक्षात्मक परत के साथ संरक्षित है और यह सुनिश्चित करने के लिए कि यह सामग्री के नुकसान के बिना अपनी स्थिरता बनाए रखता है, और यह पर्यावरण से नमी को अवशोषित नहीं करता है, यह सुनिश्चित करने के लिए फैलाने वाले एजेंटों में निलंबित किया गया है।.
इस कीचड़ का यह फायदा है कि इसे किसी भी सामान्य डीजल, गैसोलीन या पानी के पंप के माध्यम से पंप किया जा सकता है, जिससे यह आर्थिक प्रस्ताव और प्रभावी हो जाएगा.
ईंधन कोशिकाओं
मैग्नीशियम हाइड्राइड को उन्नत ईंधन कोशिकाओं के उत्पादन में, और बैटरी और ऊर्जा भंडारण के निर्माण में भी लागू किया जा सकता है.
परिवहन और ऊर्जा
पिछले दशकों के दौरान, एक ऊर्जा स्रोत के रूप में हाइड्रोजन के उपयोग पर विचार किया गया है। ईंधन के रूप में हाइड्रोजन का आरोपण, सुरक्षित और प्रतिवर्ती भंडारण प्रणालियों को खोजने की आवश्यकता है और उच्च मात्रा में क्षमता (हाइड्रोजन की मात्रा प्रति इकाई मात्रा) और ग्रेविमिट्रिक (हाइड्रोजन प्रति यूनिट द्रव्यमान की मात्रा) के साथ.
alkylation
अल्काइलेशन (सीएच अल्किल समूह जोड़ें)3आर) बुनियादी माध्यम में कार्बनिक यौगिकों की, जहां हाइड्राइड के पिघलने बिंदु की तुलना में कम सांद्रता और तापमान पर -OH समूह की उपस्थिति होती है.
इस मामले में मैग्नीशियम हाइड्राइड (एमजीएच) में मौजूद हाइड्रोजेन2), -OH समूहों के साथ मिलकर पानी बनाते हैं। मुक्त मैग्नीशियम हैलोजन प्राप्त कर सकता है जो अक्सर एल्काइल अणु के साथ होता है जो हाइड्रोकार्बन श्रृंखला से बंधने के लिए होता है.
जोखिम
पानी के साथ प्रतिक्रिया
जैसा कि पहले ही उल्लेख किया गया है, मैग्नीशियम हाइड्राइड एक ऐसा पदार्थ है जो पानी के साथ बहुत आसानी से और हिंसक रूप से प्रतिक्रिया करता है, उच्चतर विकिरणों में विस्फोट करने की क्षमता प्रस्तुत करता है.
यह इसलिए होता है क्योंकि इसकी एक्सोथर्मिक प्रतिक्रिया, अपघटन प्रतिक्रिया में जारी हाइड्रोजन गैस को प्रज्वलित करने के लिए पर्याप्त ऊष्मा उत्पन्न करती है, जिससे एक उच्चतर श्रृंखला प्रतिक्रिया होती है।.
यह पायरोफोरिक है
मैग्नीशियम हाइड्राइड भी पायरोफोरिक है, जिसका अर्थ है कि यह नम हवा की उपस्थिति में सहजता से प्रज्वलित कर सकता है, और मैग्नीशियम ऑक्साइड और पानी बनाता है.
इसकी साँस लेना ठोस अवस्था में या इसके वाष्पों के संपर्क में होने की सिफारिश नहीं की जाती है: इसकी प्राकृतिक अवस्था में पदार्थ और इसके अपघटन के उत्पाद गंभीर चोट या मौत का कारण बन सकते हैं।.
यह पानी और इसके संदूषण के संपर्क में संक्षारक समाधान उत्पन्न कर सकता है। त्वचा और आंखों के साथ संपर्क की सिफारिश नहीं की जाती है, और श्लेष्म झिल्ली में जलन भी पैदा करती है.
यह प्रदर्शित नहीं किया गया है कि मैग्नीशियम हाइड्राइड पुराने स्वास्थ्य प्रभाव पैदा कर सकता है, जैसे कि कैंसर, प्रजनन दोष या अन्य शारीरिक या मानसिक परिणाम, लेकिन इसे संभालने के लिए सुरक्षात्मक उपकरणों का उपयोग करने की सिफारिश की जाती है (विशेष रूप से श्वासयंत्र या मास्क, इसके लिए) ठीक धूल चरित्र).
इस पदार्थ के साथ काम करते समय, हवा की नमी को निम्न स्तर पर रखा जाना चाहिए, प्रज्वलन के सभी स्रोतों को बुझाना चाहिए और इसे ड्रम या अन्य कंटेनर कंटेनरों में परिवहन करना चाहिए।.
आपको हमेशा इस पदार्थ की बड़ी सांद्रता के साथ काम करने से बचना चाहिए जब इससे बचा जा सकता है, क्योंकि विस्फोट की संभावना काफी कम हो जाती है.
यदि मैग्नीशियम हाइड्राइड का एक स्पिल होता है, तो कार्य क्षेत्र को पृथक किया जाना चाहिए और एक वैक्यूम क्लीनर के साथ एकत्र की गई धूल। आपको सूखी व्यापक विधि का उपयोग कभी नहीं करना चाहिए; हाइड्राइड के साथ एक प्रतिक्रिया की संभावना बढ़ जाती है.
संदर्भ
- जुमदहल, एस.एस. (1998)। एनसाइक्लोपीडिया ब्रिटानिका। Britannica.com से लिया गया.
- PubChem। (2005)। PubChem ओपन केमिस्ट्री डेटाबेस। Pubchem.ncbi.nlm.nih.gov से लिया गया.
- सुरक्षित हाइड्रोजन, एल। (2006)। ग्रीन कार कांग्रेस। Greencarcongress.com से लिया गया.
- रसायन, सी। (N.d)। कैमियो केमिकल्स। कैमोकेमिकल्स .नोआ.ओवी से लिया गया.
- सेवाएं, एन जे (1987)। न्यू जर्सी स्वास्थ्य और वरिष्ठ सेवा विभाग। Nj.gov से लिया गया.


