कैल्शियम फॉस्फेट (Ca3 (PO4) 2) संरचना, गुण, गठन और उपयोग
कैल्शियम फॉस्फेट एक अकार्बनिक और तृतीयक नमक है जिसका रासायनिक सूत्र Ca है3(पीओ4)2. सूत्र बताता है कि इस नमक की संरचना क्रमशः कैल्शियम और फॉस्फेट के लिए 3: 2 है। इसे सीधे निचली छवि में देखा जा सकता है, जहां Ca cation दिखाया गया है2+ और अनियन पीओ43-. हर तीन सीए के लिए2+ दो पीओ हैं43- उनके साथ बातचीत.
दूसरी ओर, कैल्शियम फॉस्फेट लवणों की एक श्रृंखला को संदर्भित करता है जो सीए / पी अनुपात, साथ ही हाइड्रेशन और पीएच की डिग्री के आधार पर भिन्न होता है। वास्तव में, कई प्रकार के कैल्शियम फॉस्फेट हैं जो मौजूद हैं और उन्हें संश्लेषित किया जा सकता है। हालांकि, शाब्दिक रूप से नामकरण के बाद, कैल्शियम फॉस्फेट केवल ट्राइकल्शियम, पूर्वोक्त को संदर्भित करता है.

सीए सहित सभी कैल्शियम फॉस्फेट3(पीओ4)2, वे हल्के भूरे रंग के टन के साथ ठोस सफेद होते हैं। वे दानेदार, ठीक, क्रिस्टलीय हो सकते हैं, और कण आकार हो सकते हैं जो माइक्रोमीटर के आसपास होते हैं; और यहां तक कि, इन फॉस्फेट के नैनोकणों को तैयार किया गया है, जिसके साथ हड्डियों के लिए बायोकेमपिटल सामग्री तैयार की जाती है.
यह बायोकंपैटिबिलिटी इस तथ्य के कारण है कि ये लवण दांतों में पाए जाते हैं और संक्षेप में स्तनधारियों की हड्डियों के ऊतकों में। उदाहरण के लिए, हाइड्रॉक्सापाटाइट एक क्रिस्टलीय कैल्शियम फॉस्फेट है, जो बदले में एक ही नमक के एक अनाकार चरण के साथ बातचीत करता है.
इसका मतलब है कि अनाकार और क्रिस्टलीय कैल्शियम फॉस्फेट मौजूद हैं। इस कारण से, कैल्शियम फॉस्फेट पर आधारित सामग्री का संश्लेषण करते समय विविधता और कई विकल्प आश्चर्यचकित नहीं होते हैं; ऐसी सामग्री जिनके गुण शोधकर्ता हड्डियों की बहाली पर ध्यान केंद्रित करने के लिए दुनिया भर में हर दिन अधिक रुचि रखते हैं.
सूची
- 1 कैल्शियम फॉस्फेट की संरचना
- 1.1 अनाकार कैल्शियम फॉस्फेट
- 1.2 परिवार के बाकी सदस्य
- 2 भौतिक और रासायनिक गुण
- २.१ नाम
- २.२ आणविक भार
- २.३ शारीरिक विवरण
- २.४ स्वाद
- 2.5 गलनांक
- 2.6 घुलनशीलता
- 2.7 घनत्व
- 2.8 अपवर्तक सूचकांक
- 2.9 प्रशिक्षण की मानक थैलीपी
- 2.10 भंडारण तापमान
- 2.11 पीएच
- 3 प्रशिक्षण
- 3.1 कैल्शियम नाइट्रेट और अमोनियम हाइड्रोजन फॉस्फेट
- 3.2 कैल्शियम हाइड्रॉक्साइड और फॉस्फोरिक एसिड
- 4 उपयोग
- 4.1 अस्थि ऊतक में
- 4.2 बायोकैमिक सीमेंट
- 4.3 डॉक्टर
- 4.4 अन्य
- 5 संदर्भ
कैल्शियम फॉस्फेट की संरचना
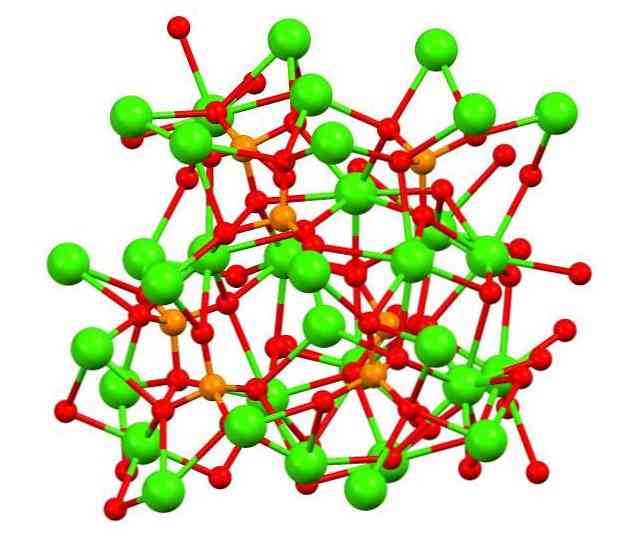
ऊपरी छवि में अजीब वाइटलॉकाइट खनिज में ट्राइबासिक कैलिको फॉस्फेट की संरचना दिखाई देती है, जिसमें मैग्नीशियम और लोहे की अशुद्धियाँ हो सकती हैं.
हालांकि पहली नज़र में यह जटिल लग सकता है, यह स्पष्ट करना आवश्यक है कि मॉडल फॉस्फेट के ऑक्सीजन परमाणुओं और कैल्शियम के धातु केंद्रों के बीच सहसंयोजक बातचीत मानता है.
प्रतिनिधित्व के माध्यम से यह मान्य है, हालांकि, बातचीत इलेक्ट्रोस्टैटिक हैं; यही कारण है कि, सीए का उद्धरण है2+ पीओ आयनों के लिए आकर्षित कर रहे हैं43- (सीए2+- O-पीओ33-)। इसे ध्यान में रखते हुए, यह समझा जाता है कि क्यों छवि में कैल्शियम (हरे रंग के गोले) नकारात्मक आवेशित ऑक्सीजन परमाणुओं (लाल क्षेत्रों) से घिरे होते हैं.
जब बहुत सारे आयन होते हैं, तो यह एक सममित व्यवस्था या पैटर्न दिखाई नहीं देता है। द सी3(पीओ4)2 कम तापमान पर गोद ले (टी<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(पीओ4)2 ((-टीसीपी, अंग्रेजी में इसके संक्षिप्त रूप के लिए).
उच्च तापमान पर, दूसरी ओर, यह बहुरूपी α-Ca में बदल जाता है3(पीओ4)2 (α-TCP), जिसकी इकाई कोशिका एक मोनोक्रेलिक क्रिस्टलीय प्रणाली से मेल खाती है। अधिक तापमान पर भी बहुरूप α'-Ca का निर्माण किया जा सकता है3(पीओ4)2, जो हेक्सागोनल क्रिस्टल संरचना का है.
अनाकार कैल्शियम फॉस्फेट
कैल्शियम फॉस्फेट के लिए क्रिस्टल संरचनाओं का उल्लेख किया गया है, जो कि नमक से अपेक्षित है। हालांकि, यह विकार और असममित संरचनाओं को प्रदर्शित करने में सक्षम है, इसकी परिभाषा के सख्त अर्थ में क्रिस्टल की तुलना में "कैल्शियम फॉस्फेट ग्लास" के एक प्रकार से अधिक जुड़ा हुआ है।.
जब ऐसा होता है, तो यह कहा जाता है कि कैल्शियम फॉस्फेट में एक अनाकार संरचना (एसीपी) है, अनाकार कैल्शियम फॉस्फेट)। कई लेखक सीए के जैविक गुणों के लिए जिम्मेदार इस प्रकार की संरचना की ओर इशारा करते हैं3(पीओ4)2 हड्डी के ऊतकों में, इसकी मरम्मत और बायोमिमेटाइजेशन संभव है.
परमाणु चुंबकीय अनुनाद (NMR) द्वारा इसकी संरचना को स्पष्ट करने के माध्यम से, ओह आयनों की उपस्थिति पाई गई है- और एचपीओ42- एसीपी में। ये आयन एक फॉस्फेट के हाइड्रोलिसिस द्वारा बनते हैं:
पीओ43- + एच2हे <=> HPO42- + ओह-
नतीजतन, एसीपी की असली संरचना अधिक जटिल हो जाती है, जिसके आयनों की संरचना सूत्र द्वारा दर्शायी जाती है: सीए9(पीओ4)6-x(HPO4)एक्स(OH)एक्स. 'X' जलयोजन की डिग्री को इंगित करता है, क्योंकि यदि x = 1 है, तो सूत्र इस प्रकार होगा: Ca9(पीओ4)5(HPO4) (ओएच).
पीसीए ने विभिन्न संरचनाओं को सीए / पी दाढ़ अनुपात पर निर्भर किया हो सकता है; यही है, कैल्शियम और फॉस्फेट के सापेक्ष मात्रा में, जो उनके सभी परिणामी संरचना को बदलते हैं.
बाकी परिवार
कैल्शियम फॉस्फेट वास्तव में अकार्बनिक यौगिकों का एक परिवार है, जो बदले में एक कार्बनिक मैट्रिक्स के साथ बातचीत कर सकते हैं.
अन्य फॉस्फेट कैल्शियम द्वारा प्राप्त आयनों को बदलकर "बस" प्राप्त किया जाता है (पीओ43-, HPO42-, एच2पीओ4-, ओह-), साथ ही ठोस में अशुद्धियों का प्रकार। इस प्रकार, ग्यारह कैल्शियम फॉस्फेट या अधिक, प्रत्येक की अपनी संरचना और गुणों के साथ, स्वाभाविक रूप से या कृत्रिम रूप से उत्पन्न हो सकते हैं।.
नीचे कुछ फॉस्फेट और उनके संबंधित संरचनाएं और रासायनिक सूत्र हैं:
-हाइड्रोजन कैल्शियम फॉस्फेट डाइहाइड्रेट, CaHPO4∙ 2H2O: मोनोक्लिनिक.
-कैल्शियम डाइहाइड्रोजेन फॉस्फेट मोनोहाइड्रेट, Ca (H)2पीओ4)2∙ ज2ओ: त्रिविम.
-निर्जल डायसिड फॉस्फेट, सीए (एच)2पीओ4)2: त्रिविम.
-Ocalcium हाइड्रोजन फॉस्फेट (OCP), सीए8एच2(पीओ4)6: त्रिविम यह हाइड्रोक्सीपाटाइट के संश्लेषण में एक अग्रदूत है.
-हाइड्रोक्सीपाटाइट, सीए5(पीओ4)3ओह: हेक्सागोनल.
भौतिक और रासायनिक गुण
नाम
-कैल्शियम फॉस्फेट
-ट्रिकल कैल्शियम फॉस्फेट
-ट्रिकल कैल्शियम डिपॉस्फेट
आणविक भार
310.74 ग्राम / मोल.
शारीरिक विवरण
यह एक गंधहीन सफेद ठोस होता है.
स्वाद
बेस्वाद.
गलनांक
1670 ºK (1391 )C).
घुलनशीलता
-पानी में व्यावहारिक रूप से अघुलनशील.
-इथेनॉल में अघुलनशील.
-तनु हाइड्रोक्लोरिक एसिड और नाइट्रिक एसिड में घुलनशील.
घनत्व
3.14 ग्राम / सेमी3.
अपवर्तनांक
1,629
प्रशिक्षण की मानक थैलीपी
4126 किलो कैलोरी / मोल.
भंडारण तापमान
2-8 º सी.
पीएच
कैल्शियम फॉस्फेट के 50 ग्राम / एल के एक जलीय निलंबन में 6-8.
ट्रेनिंग
कैल्शियम नाइट्रेट और हाइड्रोजन अमोनियम फॉस्फेट
कैल्शियम फॉस्फेट के उत्पादन या निर्माण के लिए कई तरीके हैं। उनमें से एक में दो लवणों का मिश्रण होता है, Ca (NO)3)2∙ 4H2ओ, और (एनएच)4)2HPO4, पहले क्रमशः पूर्ण शराब और पानी में घुल गया। एक नमक कैल्शियम प्रदान करता है, और दूसरा फॉस्फेट.
इस मिश्रण से एसीपी अवक्षेपित हो जाता है, जिसे बाद में 800 ° C पर ओवन में 2 घंटे के लिए गर्म किया जाता है। इस प्रक्रिया के परिणामस्वरूप, β-Ca प्राप्त होता है3(पीओ4)2. तापमान, आंदोलन और संपर्क समय को सावधानीपूर्वक नियंत्रित करने से, नैनोक्रिस्टल गठन हो सकता है.
बहुरूप α-Ca बनाने के लिए3(पीओ4)2 1000 डिग्री सेल्सियस से ऊपर फॉस्फेट को गर्म करना आवश्यक है। यह हीटिंग अन्य धातु आयनों की उपस्थिति में किया जाता है, जो कमरे के तापमान पर इसका उपयोग करने के लिए पर्याप्त रूप से इस बहुरूप को स्थिर करते हैं; अर्थात्, यह एक स्थिर मेटा स्थिति में रहता है.
कैल्शियम हाइड्रॉक्साइड और फॉस्फोरिक एसिड
कैल्शियम हाइड्रोक्साइड और फॉस्फोरिक एसिड के समाधानों को मिलाकर कैल्शियम फॉस्फेट भी बनाया जा सकता है, एसिड-बेस न्यूट्रलाइज़ेशन के साथ। माँ शराब में पकने के आधे दिन के बाद, और उनके उचित निस्पंदन, धोने, सुखाने और सफ़ाई करने के बाद, अनाकार फॉस्फेट का एक दानेदार पाउडर प्राप्त किया जाता है,.
उच्च तापमान का यह एसीपी अभिक्रिया उत्पाद, निम्नलिखित रासायनिक समीकरणों के अनुसार परिवर्तित होता है:
2ca9(HPO4) (पीओ4)5(OH) => 2Ca9(पी2हे7)0.5(पीओ4)5(ओएच) + एच2O (T = 446.60 ° C पर)
2ca9(पी2हे7)0.5(पीओ4)5(OH) => 3Ca3(पीओ4)2 + 0.5H2O (T = 748.56 ° C पर)
इस तरह, this-Ca प्राप्त होता है3(पीओ4)2, इसका सबसे आम और स्थिर बहुरूपता है.
अनुप्रयोगों
हड्डी के ऊतकों में
द सी3(पीओ4)2 यह हड्डी की राख का मुख्य अकार्बनिक घटक है। यह हड्डी के प्रतिस्थापन प्रत्यारोपण का एक घटक है, यह हड्डी में मौजूद खनिजों के लिए इसकी रासायनिक समानता द्वारा समझाया जा रहा है.
कैल्शियम फॉस्फेट बायोमेट्रिक का उपयोग हड्डी के दोषों को ठीक करने और टाइटेनियम धातु कृत्रिम अंग के लेप में किया जाता है। कैल्शियम फॉस्फेट उन पर जमा होता है, उन्हें पर्यावरण से अलग करता है और टाइटेनियम जंग प्रक्रिया को धीमा करता है.
सीए सहित कैल्शियम फॉस्फेट3(पीओ4)2, उनका उपयोग सिरेमिक सामग्री के उत्पादन के लिए किया जाता है। ये सामग्री बायोकम्पैटिबल हैं, और वर्तमान में एल्वोलर हड्डी के नुकसान को बहाल करने के लिए उपयोग की जाती हैं, जिसके परिणामस्वरूप पीरियडोंटल बीमारी, एंडोडॉन्टिक संक्रमण और अन्य स्थितियां हैं।.
हालांकि, उनका उपयोग केवल पेरिअपिकल हड्डी की मरम्मत में तेजी लाने के लिए किया जाना चाहिए, उन क्षेत्रों में जहां कोई क्रोनिक बैक्टीरियल संक्रमण नहीं है.
कैल्शियम फॉस्फेट का उपयोग हड्डी के दोषों की मरम्मत में किया जा सकता है, जब एक ऑटोजेनस हड्डी ग्राफ्ट का उपयोग करना संभव नहीं होता है। पॉलीग्लाइकोलिक एसिड जैसे बायोडिग्रेडेबल और रिसोर्बेबल बहुलक के साथ इसे अकेले या संयोजन में उपयोग करना संभव है.
बायोकेमिकल सीमेंट्स
कैल्शियम फॉस्फेट सीमेंट (सीपीसी) हड्डी के ऊतकों की मरम्मत में उपयोग किया जाने वाला एक और जैवरासायनिक है। यह पानी के साथ विभिन्न प्रकार के कैल्शियम फॉस्फेट के पाउडर को मिलाकर एक पेस्ट बनाकर बनाया जाता है। पेस्ट को इंजेक्ट किया जा सकता है या हड्डी दोष या गुहा में समायोजित किया जा सकता है.
सीमेंट को ढाला जाता है, धीरे-धीरे पुनर्निर्मित किया जाता है और नवगठित हड्डी द्वारा प्रतिस्थापित किया जाता है.
मेडिकल
-द सी3(पीओ4)2 यह एक मूल नमक है, इसलिए इसे अतिरिक्त पेट के एसिड को बेअसर करने और पीएच बढ़ाने के लिए एक एंटासिड के रूप में उपयोग किया जाता है। टूथपेस्ट में, यह कैल्शियम और फॉस्फेट का एक स्रोत प्रदान करता है ताकि दांतों और हड्डी के हेमोस्टेसिस के पुन: अंतिम संस्कार की प्रक्रिया को आसान बनाया जा सके.
-इसका उपयोग पोषण पूरक के रूप में भी किया जाता है, हालांकि कैल्शियम को बदलने का सबसे सस्ता तरीका इसके कार्बोनेट और साइट्रेट के उपयोग के माध्यम से है।.
-कैल्शियम फॉस्फेट का उपयोग टेटनी, अव्यक्त हाइपोकैल्सीमिया और रखरखाव चिकित्सा के उपचार में किया जा सकता है। इसके अलावा, यह गर्भावस्था और दुद्ध निकालना के दौरान कैल्शियम पूरकता में उपयोगी है.
-इसका उपयोग रेडियोधर्मी आइसोटोप रेडियो (आरए -226) और स्ट्रोंटियम (सीन -90) के साथ संदूषण के उपचार में किया जाता है। कैल्शियम फॉस्फेट पाचन तंत्र में रेडियोधर्मी आइसोटोप के अवशोषण को अवरुद्ध करता है, इस प्रकार उनके कारण होने वाले नुकसान को सीमित करता है.
अन्य लोग
-कैल्शियम फॉस्फेट का उपयोग पक्षियों के लिए भोजन के रूप में किया जाता है। इसके अलावा, टार्टर को नियंत्रित करने के लिए टूथपेस्ट में इसका उपयोग किया जाता है.
-इसका उपयोग एंटी-काकिंग एजेंट के रूप में किया जाता है, उदाहरण के लिए टेबल नमक को जमा होने से रोकने के लिए.
-यह आटे के लिए विरंजन एजेंट के रूप में काम करता है। जबकि, सुअर के लॉर्ड में एक अवांछित रंग को रोकता है और फ्राइंग की स्थिति में सुधार करता है.
संदर्भ
- तुंग एम.एस. (1998) कैल्शियम फॉस्फेट: संरचना, संरचना, विलेयता, और स्थिरता। इन: अमजद जेड (eds) जैविक और औद्योगिक प्रणालियों में कैल्शियम फॉस्फेट। स्प्रिंगर, बोस्टन, एमए.
- लैंगलैंग लियू, यानजेंग वू, चाओ जू, सुकुन यू, शियाओपी वू और होंग्लियान दाई। (2018)। "नैनोमेट्रिकल्स जर्नल" वॉल्यूम, सिंथेसिस, नैनो-Ph-ट्रिकल कैल्शियम फॉस्फेट और हेपैटोसेलुलर कार्सिनोमा कोशिकाओं पर निषेध। 2018, अनुच्छेद आईडी 7083416, 7 पृष्ठ, 2018.
- जोड़ती है, मसीह और रे, ईसाई। (2010)। अनाकार कैल्शियम फॉस्फेट: संश्लेषण, गुण और जैव पदार्थों में उपयोग करता है। एक्टा बायोमेटेरिया, वॉल्यूम। 6 (एन ° 9)। पीपी। 3362-3378। आईएसएसएन 1742-7061
- विकिपीडिया। (2019)। ट्रिकल कैल्शियम फॉस्फेट। से लिया गया: en.wikipedia.org
- आबिदा एट अल। (2017)। Tricalcium फॉस्फेट पाउडर: तैयारी, लक्षण वर्णन और संघनन क्षमता। 2017, 6 (3), 71-76 के मेडिटेरेनियन जर्नल ऑफ केमिस्ट्री.
- PubChem। (2019)। कैल्शियम फॉस्फेट। से लिया गया: pubchem.ncbi.nlm.nih.gov
- Elsevier। (2019)। कैल्शियम फॉस्फेट। विज्ञान प्रत्यक्ष। से लिया गया: scoubleirect.com


