ईथेन संरचना, गुण, उपयोग और जोखिम
एटैन सूत्र C का एक सरल हाइड्रोकार्बन है2एच6 एथिलीन के संश्लेषण में अत्यधिक मूल्यवान और विविध उपयोग वाली रंगहीन और गंधहीन गैस की प्रकृति के साथ। इसके अलावा, यह उन स्थलीय गैसों में से एक है जिनका सौर मंडल के आसपास के अन्य ग्रहों और तारा पिंडों में भी पता चला है। इसकी खोज वैज्ञानिक माइकल फैराडे ने वर्ष 1834 में की थी.
कार्बन और हाइड्रोजन परमाणुओं (हाइड्रोकार्बन के रूप में जाना जाता है) द्वारा गठित कार्बनिक यौगिकों की बड़ी संख्या के बीच, वे हैं जो तापमान और पर्यावरणीय दबाव पर एक गैसीय अवस्था में हैं, जो कई उद्योगों में बड़े पैमाने पर उपयोग किए जाते हैं.
ये आम तौर पर "प्राकृतिक गैस" नामक गैसीय मिश्रण से आते हैं, जो मानवता के लिए उच्च मूल्य का उत्पाद है, और मीथेन प्रकार मीथेन, ईथेन, प्रोपेन और ब्यूटेन, अन्य के बीच बनाते हैं; इसकी श्रृंखला में कार्बन परमाणुओं की मात्रा के अनुसार वर्गीकृत किया गया है.
सूची
- 1 रासायनिक संरचना
- 1.1 इथेन का संश्लेषण
- 2 गुण
- 2.1 इथेन की घुलनशीलता
- 2.2 इथेन का क्रिस्टलीकरण
- 2.3 एथेन का दहन
- 2.4 वायुमंडल में और आकाशीय पिंडों में एथेन
- ३ उपयोग
- 3.1 एथिलीन उत्पादन
- 3.2 बुनियादी रसायनों का प्रशिक्षण
- ३.३ सर्द
- एथेन के 4 जोखिम
- 5 संदर्भ
रासायनिक संरचना
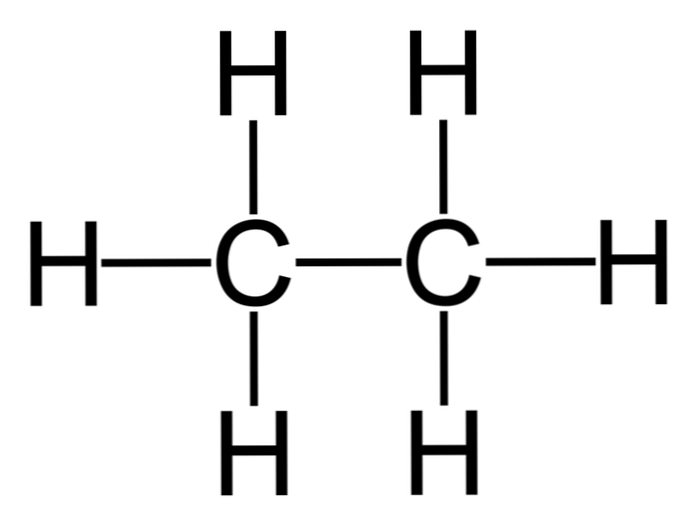
ईथेन सूत्र C के साथ एक अणु है2एच6, आमतौर पर दो मिथाइल समूहों (-CH) के मिलन के रूप में देखा जाता है3) एक साधारण कार्बन-कार्बन बांड के हाइड्रोकार्बन का निर्माण करना। मीथेन के बाद यह सबसे सरल कार्बनिक यौगिक भी है, जिसका प्रतिनिधित्व इस प्रकार है:
एच3सी-CH3
इस अणु में कार्बन परमाणुओं में संकरण होता है3, अतः आणविक बंधन मुक्त घूर्णन को प्रस्तुत करते हैं.
इसके अलावा, ईथेन की एक आंतरिक घटना है, जो उसी की आणविक संरचना के रोटेशन और 360 डिग्री के बंधन के उत्पादन के लिए आवश्यक न्यूनतम ऊर्जा पर आधारित है, जिसे वैज्ञानिकों ने "ईथेन बैरियर" कहा है.
इस कारण से, इथेन अपने रोटेशन के अनुसार अलग-अलग विन्यासों में हो सकता है, भले ही इसकी अधिक स्थिर रचना मौजूद है जहां हाइड्रोजेन एक दूसरे के विपरीत हैं (जैसा कि चित्र में दिखाया गया है).

इथेन का संश्लेषण
कोल्हे के इलेक्ट्रोलिसिस से एथेन को आसानी से संश्लेषित किया जा सकता है, एक कार्बनिक प्रतिक्रिया जिसमें दो चरण होते हैं: दो कार्बोक्जिलिक एसिड का एक इलेक्ट्रोकेमिकल डिकार्बोक्सेलेशन (कार्बोक्सिल समूह और कार्बन डाइऑक्साइड की रिहाई), और उत्पादों का संयोजन एक सहसंयोजक बंधन बनाने के लिए मध्यवर्ती.
इसी तरह, एसिटिक एसिड के इलेक्ट्रोलिसिस एथेन और कार्बन डाइऑक्साइड के निर्माण की ओर जाता है, और इस प्रतिक्रिया का उपयोग पहले को संश्लेषित करने के लिए किया जाता है.
पेरोक्साइड की कार्रवाई से एसिटिक एनहाइड्राइड का ऑक्सीकरण, कोल्बे के इलेक्ट्रोलिसिस के समान एक अवधारणा, भी एथेन के गठन का परिणाम है.
उसी तरह, यह तरलीकरण प्रक्रिया द्वारा प्राकृतिक गैस और मीथेन से कुशलतापूर्वक अलग किया जा सकता है, इस गैस को पकड़ने के लिए क्रायोजेनिक सिस्टम का उपयोग करके और इसे अन्य गैसों के साथ मिश्रण से अलग किया जा सकता है।.
इस भूमिका के लिए टर्बोपेक्जिशन प्रक्रिया को प्राथमिकता दी जाती है: गैस मिश्रण को टरबाइन के माध्यम से पारित किया जाता है, जिससे एक विस्तार उत्पन्न होता है, जब तक कि इसका तापमान -100ºC से नीचे नहीं जाता है.
पहले से ही इस बिंदु पर, मिश्रण के घटकों को विभेदित किया जा सकता है, ताकि तरल इथेन गैसीय मीथेन से अलग हो जाएगा और एक आसवन के उपयोग के साथ शामिल अन्य प्रजातियां.
गुण
एथेन प्रकृति में मानक दबाव और तापमान (1 एटीएम और 25 डिग्री सेल्सियस) पर गंधहीन और रंगहीन गैस के रूप में होता है। इसमें -88.5 andC का क्वथनांक और -182.8 .C का गलनांक होता है। इसके अलावा, यह मजबूत एसिड या ठिकानों के संपर्क से प्रभावित नहीं होता है.
इथेनॉल घुलनशीलता
एथेन के अणु सममितीय विन्यास के होते हैं और उनमें आकर्षण की कमजोर शक्तियां होती हैं जो उन्हें एक साथ रखती हैं, जिन्हें फैलाव की ताकत कहा जाता है.
जब इथेन को पानी में घोलने की कोशिश की जाती है, तो गैस और तरल के बीच आकर्षण बल बहुत कमजोर हो जाता है, जिससे पानी के अणुओं के साथ एथेन को मिलाना बहुत मुश्किल हो जाता है.
इस कारण से, एथेन की घुलनशीलता काफी कम है, जब सिस्टम दबाव बढ़ जाता है तो थोड़ा बढ़ जाता है.
एथेन का क्रिस्टलीकरण
ईथेन को ठोस किया जा सकता है, जिसके परिणामस्वरूप एक घन क्रिस्टलीय संरचना के साथ अस्थिर एथेन क्रिस्टल का निर्माण होता है.
-183.2 डिग्री सेल्सियस से परे तापमान में कमी के साथ, यह संरचना अपने अणु की स्थिरता को बढ़ाते हुए, मोनोक्लिनिक बन जाती है.
एथेन दहन
यह हाइड्रोकार्बन, भले ही इसे व्यापक रूप से ईंधन के रूप में उपयोग नहीं किया जाता है, इसका उपयोग दहन प्रक्रियाओं में कार्बन डाइऑक्साइड, पानी और गर्मी उत्पन्न करने के लिए किया जा सकता है, जिसे निम्नानुसार दर्शाया गया है:
2C2एच6 + 7o2 → 4CO2 + 6H2ओ + 3120 केजे
ऑक्सीजन की अधिकता के बिना इस अणु को जलाने की संभावना भी है, जिसे "अपूर्ण दहन" के रूप में जाना जाता है, और जिसके परिणामस्वरूप अवांछित प्रतिक्रिया में अनाकार कार्बन और कार्बन मोनोऑक्साइड का निर्माण होता है, जो ऑक्सीजन की मात्रा पर निर्भर करता है। :
2C2एच6 + 3O2 → 4 सी + 6 एच2ओ + ताप
2C2एच6 + 4O2 → 2C + 2CO + 6H2ओ + ताप
2C2एच6 + 5O2 → 4CO + 6H2ओ + ताप
इस क्षेत्र में, दहन मुक्त कट्टरपंथी प्रतिक्रियाओं की एक श्रृंखला के माध्यम से होता है, जो सैकड़ों विभिन्न प्रतिक्रियाओं में गिने जाते हैं। उदाहरण के लिए, अधूरा दहन प्रतिक्रियाओं में फॉर्मलाडेहाइड, एसिटालडिहाइड, मीथेन, मेथनॉल और इथेनॉल जैसे यौगिकों का गठन किया जा सकता है।.
यह उन स्थितियों पर निर्भर करेगा जिनके तहत प्रतिक्रिया होती है और मुक्त कण प्रतिक्रियाएं शामिल होती हैं। एथिलीन का गठन उच्च तापमान (600-900 ,C) पर भी किया जा सकता है, जो उद्योग द्वारा अत्यधिक वांछित उत्पाद है.
वायुमंडल और आकाशीय पिंडों में एथेन
ईथेन ग्रह पृथ्वी के वातावरण में मौजूद है, और यह संदेह है कि मानव इस एकाग्रता को दोगुना करने में कामयाब रहा है क्योंकि उसने औद्योगिक गतिविधियों का अभ्यास करना शुरू कर दिया है.
वैज्ञानिकों का मानना है कि वायुमंडल में ईथेन की वर्तमान उपस्थिति जीवाश्म ईंधन के दहन के कारण है, हालांकि शेल गैस उत्पादन प्रौद्योगिकियों में सुधार के बाद से ईथेन का वैश्विक उत्सर्जन लगभग आधा घट गया है ( प्राकृतिक गैस स्रोत).
यह प्रजाति भी प्राकृतिक रूप से वायुमंडलीय मीथेन पर सौर किरणों के प्रभाव से पैदा होती है, जो पुनर्संयोजन करती है और एथेन के अणु का निर्माण करती है.
इथेन, टाइटन की सतह पर एक तरल अवस्था में मौजूद है, जो शनि के चंद्रमाओं में से एक है। विडम फ्लुमिना नदी में यह अधिक मात्रा में होता है, जो कि इसके एक समुद्र की ओर 400 किलोमीटर से अधिक दूरी तक बहती है। इस यौगिक को धूमकेतु और प्लूटो की सतह पर भी उतारा गया है.
अनुप्रयोगों
एथिलीन उत्पादन
इथेन का उपयोग मुख्य रूप से एथिलीन के उत्पादन पर आधारित है, जो विश्व उत्पादन में सबसे अधिक इस्तेमाल किया जाने वाला जैविक उत्पाद है, भाप बनाने के रूप में जाना जाता है।.
इस प्रक्रिया में एक ओवन में भाप के साथ पतला एथेन का एक फ़ीड पारित करना शामिल है, इसे ऑक्सीजन के बिना जल्दी से गर्म करना.
प्रतिक्रिया अत्यधिक उच्च तापमान (850 और 900 ,C के बीच) पर होती है, लेकिन प्रतिक्रिया के प्रभावी होने के लिए निवास का समय (ओवन के अंदर ईथेन द्वारा बिताया गया समय) होना चाहिए। उच्च तापमान पर, अधिक एथिलीन उत्पन्न होता है.
बुनियादी रसायनों का प्रशिक्षण
बुनियादी रसायनों के निर्माण में एक मुख्य घटक के रूप में भी ईथेन का अध्ययन किया गया है। ऑक्सीडेटिव क्लोरीनेशन विनाइल क्लोराइड (पीवीसी का एक घटक) प्राप्त करने के लिए प्रस्तावित प्रक्रियाओं में से एक है, कम महंगी और अधिक जटिल की जगह.
शीतल
अंत में, एथेन का उपयोग आम क्रायोजेनिक सिस्टम में एक सर्द के रूप में किया जाता है, विश्लेषण में प्रयोगशाला में छोटे नमूनों को फ्रीज करने की क्षमता भी दिखाता है.
यह पानी के लिए एक बहुत अच्छा विकल्प है, जो नाजुक नमूनों को ठंडा करने में अधिक समय लेता है, और हानिकारक बर्फ क्रिस्टल के निर्माण को भी उत्पन्न कर सकता है.
ईथेन जोखिम
-ईथेन में आग लगने की क्षमता होती है, खासकर जब यह हवा के साथ बांधता है। हवा में इथेन के 3.0 से 12.5% मात्रा के प्रतिशत में, एक विस्फोटक मिश्रण बन सकता है.
-यह उस हवा में ऑक्सीजन को सीमित कर सकता है जिसमें यह पाया जाता है, और इस कारण से यह मौजूद लोगों और जानवरों के लिए घुटन का एक जोखिम कारक प्रस्तुत करता है और उजागर होता है.
-जमे हुए तरल रूप में ईथेन गंभीर रूप से त्वचा को जला सकता है अगर इसके साथ सीधे संपर्क में आता है, और यह किसी भी वस्तु के लिए क्रायोजेनिक माध्यम के रूप में कार्य करता है जो इसे छूता है, इसे क्षणों में ठंड कर देता है.
-तरल इथेन के वाष्प हवा की तुलना में भारी होते हैं और जमीन पर केंद्रित होते हैं, इससे प्रज्वलन का खतरा हो सकता है जो एक श्रृंखला दहन प्रतिक्रिया उत्पन्न कर सकता है.
-ईथेन का अंतर्ग्रहण मतली, उल्टी और आंतरिक रक्तस्राव का कारण बन सकता है। साँस लेना, घुटन के अलावा, सिरदर्द, भ्रम और मिजाज का कारण बनता है। उच्च जोखिम में कार्डियक अरेस्ट के कारण मौत संभव है.
-यह एक ग्रीनहाउस गैस का प्रतिनिधित्व करता है, जो मीथेन और कार्बन डाइऑक्साइड के साथ मिलकर मानव प्रदूषण से उत्पन्न ग्लोबल वार्मिंग और जलवायु परिवर्तन में योगदान देता है। सौभाग्य से, यह मीथेन की तुलना में कम प्रचुर मात्रा में और टिकाऊ है, और इससे कम विकिरण को अवशोषित करता है.
संदर्भ
- ब्रिटानिका, ई। (S.f.)। ईथेन। Britannica.com से लिया गया
- Nes, G. V. (s.f.)। ईथेन, एथिलीन और एसिटिलीन के एकल-क्रिस्टल संरचना और इलेक्ट्रॉन घनत्व वितरण। बीहड़ से बरामद। एनएल
- साइट्स, जी। (S.f.)। एथेन: स्रोत और सिंक। Sites.google.com से प्राप्त किया गया
- SoftSchools। (एन.डी.)। एथेन सूत्र। Softschools.com से पुनर्प्राप्त
- विकिपीडिया। (एन.डी.)। ईथेन। En.wikipedia.org से लिया गया


