एल्यूमीनियम क्लोराइड (AlCl3) रासायनिक संरचना, गुण, उपयोग
एल्यूमीनियम क्लोराइड या एल्यूमीनियम ट्राइक्लोराइड (AlCl)3) एल्यूमीनियम और क्लोरीन द्वारा गठित एक द्विआधारी नमक है। कभी-कभी यह पीले रंग के पाउडर के रूप में प्रकट होता है क्योंकि यह लोहे (III) क्लोराइड की उपस्थिति के कारण अशुद्धियां प्रस्तुत करता है.
इसके तत्वों को मिलाकर इसे प्राप्त किया जाता है। एल्यूमीनियम, जिसके अंतिम ऊर्जा स्तर (परिवार IIIA) में तीन इलेक्ट्रॉन हैं, अपने धात्विक चरित्र के कारण उन्हें उपज देता है। अपने अंतिम ऊर्जा स्तर (VIIA परिवार) में सात इलेक्ट्रॉनों के साथ क्लोरीन उन्हें अपने ओकटेट को पूरा करने के लिए देता है.
यह माना जाता है कि एल्यूमीनियम और क्लोरीन के बीच एल्यूमीनियम ट्राइक्लोराइड में बना बंधन सहसंयोजक होता है, हालांकि यह एक धातु और एक गैर-धातु के बीच का संघ है.
एल्यूमीनियम क्लोराइड के दो प्रकार हैं:
- निर्जल एल्यूमीनियम क्लोराइड। AlCl3.
- एल्यूमीनियम क्लोराइड हेक्साहाइड्रेट। AlCl3. 6H2O. यह यौगिक ठोस या विलयन रूप में पाया जा सकता है.
सूची
- 1 रासायनिक संरचना
- 2 गुण
- २.१ शारीरिक
- २.२ रासायनिक
- ३ उपयोग
- 4 जोखिम: संभावित प्रभाव
- 5 सिफारिशें
- 6 संदर्भ
रासायनिक संरचना
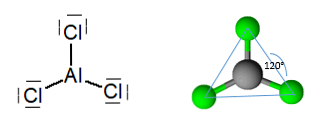
निर्जल एल्युमिनियम ट्राइक्लोराइड, एक अणु है जो एक प्लांटर ट्रायोनल ज्यामिति के साथ होता है, जिसमें परमाणु संकरण सपा के 120 ° के कोण के साथ होता है2.
हालांकि, अणु का आयोजन रूप में किया जाता है dimers, जिसमें एक क्लोरीन परमाणु बांड बनाने के लिए इलेक्ट्रॉनों की एक जोड़ी दान करता है। इन्हें समन्वित सहसंयोजक बंध के रूप में जाना जाता है.
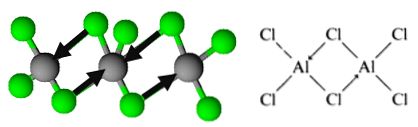
यह है कि एल्यूमीनियम ट्राइक्लोराइड डिमर्स के संगठन को कैसे घटाया जाता है.
यह संगठन कंपाउंड को डिमरिक लेयर्स के नेटवर्क बनाने की अनुमति देता है। जब ठोस एल्युमिनियम ट्राइक्लोराइड पर पानी डाला जाता है, तो वे आयनिक यौगिकों से अपेक्षित रूप से अलग नहीं होते हैं, लेकिन जोरदार हाइड्रोलिसिस से गुजरते हैं.
इसके विपरीत, पतला जलीय घोल में समन्वित आयन होते हैं [अल (एच)2ओ)6]+3 और क्लोराइड। ये संरचनाएं डिबोराने के समान हैं.
इस तरह आपके पास सूत्र अल है2क्लोरीन6
यदि इस यौगिक में बंध बनाने वाले परमाणुओं की वैद्युतीयऋणात्मकता में अंतर मापा जाता है, तो निम्न हो सकते हैं:
एल्युमिनियम अल के लिए वैद्युतीयऋणात्मकता का मान 1.61 C है और क्लोरीन का 3.16 C है। वैद्युतीयऋणात्मकता का अंतर 1.55 C है।.
बाइंडिंग सिद्धांत के नियमों के अनुसार, एक यौगिक के आयनिक होने के लिए परमाणुओं की वैद्युतीयऋणात्मकता में अंतर होना चाहिए जो 1.7 C से अधिक या उसके बराबर मूल्य के बंधन को बनाते हैं।.
अल-क्ल बंध के मामले में, वैद्युतीयऋणात्मकता में अंतर 1.55 C है, जो एल्यूमीनियम ट्राइक्लोराइड को सहसंयोजक बंधन व्यवस्था देता है। इस मामूली मूल्य को अणु द्वारा प्रस्तुत समन्वित सहसंयोजक बंधों के लिए जिम्मेदार ठहराया जा सकता है.
गुण
भौतिक
दिखावट: फेरिक क्लोराइड के कारण होने वाली अशुद्धियों के कारण सफेद ठोस, कभी-कभी पीला
घनत्व: 2.48 ग्राम / एमएल
दाढ़ द्रव्यमान: 133.34 ग्राम / मोल
उच्च बनाने की क्रिया: 178 डिग्री सेल्सियस पर उच्चतर होता है, इसलिए इसके पिघलने और क्वथनांक बहुत कम होते हैं.
ड्राइव: बिजली का खराब संचालन करता है.
घुलनशीलता: यह पानी में घुलनशील नहीं है क्योंकि यह एक लुईस एसिड है। यह कार्बनिक सॉल्वैंट्स जैसे बेंजीन, कार्बन टेट्राक्लोराइड और क्लोरोफॉर्म में घुलनशील है.
रासायनिक
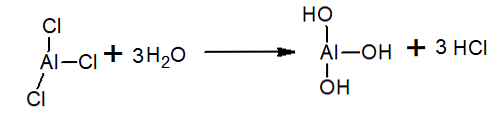
पानी में एल्युमिनियम ट्राइक्लोराइड हाइड्रोक्लोराइड बनाकर एचसीएल और हाइड्रोनियम आयन और एल्यूमीनियम हाइड्रॉक्साइड होता है:
यह फ्रेडेल-शिल्प प्रतिक्रियाओं में उत्प्रेरक के रूप में उपयोग किया जाता है (पदार्थ जो प्रतिक्रिया के अंत में पुनर्प्राप्त किया जा सकता है, क्योंकि यह केवल प्रतिक्रिया को तेज करने, धीमा करने या आरंभ करने के लिए है).
यह एक संक्षारक पदार्थ है.
अपघटन में जब यह पानी के साथ हिंसक प्रतिक्रिया करता है तो यह एल्यूमीनियम क्लोराइड और हाइड्रोजन क्लोराइड जैसी खतरनाक गैसों का उत्पादन करता है.
अनुप्रयोगों
- antiperspirant.
- फ्रिल्ड-शिल्प के एसाइलेशन और एल्केलाइजेशन में उत्प्रेरक.
जोखिम: संभव प्रभाव
- यह एक संक्षारक पदार्थ है, त्वचा पर जलन और आंखों की गंभीर क्षति का कारण बनता है.
- पानी के साथ हिंसक प्रतिक्रिया करता है.
- यह पर्यावरण के लिए खतरनाक है.
- जलीय जीवों के लिए बहुत जहरीला.
सिफारिशें
आवश्यक सुरक्षा उपायों के बिना उत्पाद के संपर्क से बचें। सेफ्टी ग्लास, दस्ताने, उचित कपड़े, ढके हुए जूते का उपयोग करना चाहिए.
साँस लेने के मामले में. धूल की साँस लेना पदार्थ की संक्षारक प्रकृति के कारण श्वसन पथ को परेशान कर सकता है। लक्षणों में गले में खराश, खांसी और सांस की तकलीफ शामिल हैं। फुफ्फुसीय एडिमा के लक्षण देर से हो सकते हैं और गंभीर मामले घातक हो सकते हैं। पीड़ितों को बिना किसी दूषित जगह के हवादार स्थान पर ले जाएं। यदि आवश्यक हो तो कृत्रिम श्वसन प्रदान करें। यदि आपको सांस लेने में कठिनाई हो, तो ऑक्सीजन प्रदान करें। डॉक्टर को बुलाओ.
त्वचा के संपर्क के मामले में. AlCl3 यह संक्षारक है। यह लालिमा और दर्द के साथ जलन या जलन पैदा कर सकता है। कम से कम 20 मिनट के लिए भरपूर पानी के संपर्क में आने के तुरंत बाद धो लें। पानी के अलावा अन्य पदार्थों को बेअसर या न जोड़ें। दूषित कपड़े निकालें और पुन: उपयोग करने से पहले इसे धो लें। चोट लगने की स्थिति में तुरंत डॉक्टर से सलाह लें.
आँखों के संपर्क में आने पर. AlCl3 यह संक्षारक है। यह तीव्र दर्द, धुंधली दृष्टि और ऊतक क्षति का कारण बनता है। कम से कम 20 मिनट के लिए पानी से आँखों को तुरंत रगड़ें, और यह सुनिश्चित करने के लिए पलकें खुली रखें कि पलक की पूरी आंख और ऊतक साफ हो गए हैं। अधिकतम प्रभाव प्राप्त करने के लिए सेकंड के एक मामले में आंखों को फ्लश करना आवश्यक है। यदि आपके पास संपर्क लेंस हैं, तो उन्हें पहले 5 मिनट के बाद हटा दें और फिर अपनी आंखों को रिंस करना जारी रखें। डॉक्टर से सलाह लें। यह कॉर्निया, कंजाक्तिवा या आंख के अन्य हिस्सों को गंभीर नुकसान पहुंचा सकता है.
घूस के मामले में. AlCl3 यह संक्षारक है। जलन से मुंह और घुटकी में दर्द हो सकता है और श्लेष्म झिल्ली की जलन हो सकती है। यह पेट में दर्द, मतली, उल्टी और दस्त के साथ गैस्ट्रोइंटेस्टाइनल असुविधा पैदा कर सकता है। इनकमिंग वोटिंग को शामिल न करें। मुंह को कुल्ला, और पीने के लिए पानी दें। अचेतन व्यक्ति को कभी भी कुछ भी मौखिक रूप से न दें। डॉक्टर को बुलाओ। अगर उल्टी अनायास होती है, तो आकांक्षा के जोखिम को कम करने के लिए पीड़ित को अपनी तरफ रखें.
मौजूदा त्वचा विकार या आंखों की समस्या या बिगड़ा हुआ श्वसन समारोह वाले लोग पदार्थ के प्रभाव के प्रति अधिक संवेदनशील हो सकते हैं
AlCl यौगिक की पैकिंग और भंडारण3 हवादार, साफ और सूखे स्थानों पर किया जाना चाहिए.
संदर्भ
- रासायनिक पुस्तक, (2017), एल्यूमीनियम क्लोराइड। Chemicalbook.com से पुनर्प्राप्त
- cosmos ऑनलाइन, cosmos.com.mx
- शार्प, ए.जी., (1993), ऑर्गेनिक केमिस्ट्री, स्पेन, संपादकीय रिवर्ट, एस.ए..
- एफ।, (2017), एलएक्सएल एल्यूमीनियम क्लोराइड3, दि इंसिग्निया. से लिया गयाblog.elinsignia.com.
- TriHealth, (2018), एल्युमिनियम ट्रायक्लोराइड, अंतिम अद्यतन, 4 मार्च 2018, trihealth.adv.com से लिया गया.
- RxWiki, (s.f), एल्यूमीनियम क्लोराइड, rxwiki.com से लिया गया.


