रासायनिक समीकरण विधियों और उदाहरणों का संतुलन
रासायनिक समीकरणों का संतुलन तात्पर्य यह है कि उक्त समीकरण में मौजूद सभी तत्वों में प्रत्येक तरफ परमाणुओं की संख्या समान है। इसे प्राप्त करने के लिए प्रतिक्रिया में मौजूद प्रत्येक प्रजाति के लिए उपयुक्त स्टोइकोमेट्रिक गुणांक निर्दिष्ट करने के लिए संतुलन विधियों का उपयोग करना आवश्यक है.
रासायनिक समीकरण दो या अधिक पदार्थों के बीच रासायनिक प्रतिक्रिया के दौरान प्रतीकों के माध्यम से प्रतिनिधित्व होता है। अभिकारक एक दूसरे के साथ बातचीत करते हैं और, प्रतिक्रिया की स्थिति के आधार पर, एक या अधिक विभिन्न यौगिकों को एक उत्पाद के रूप में प्राप्त किया जाएगा।.
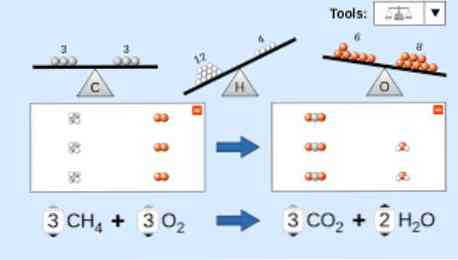
रासायनिक समीकरण का वर्णन करते समय, निम्नलिखित को ध्यान में रखा जाना चाहिए: सबसे पहले, प्रतिक्रियाशील पदार्थ समीकरण के बाईं ओर लिखे जाते हैं, इसके बाद एक यूनिडायरेक्शनल तीर या दो विपरीत क्षैतिज तीर होते हैं, जो प्रतिक्रिया के प्रकार पर निर्भर करता है। केप.
सूची
- रासायनिक समीकरणों को संतुलित करने के 1 तरीके
- 1.1 परीक्षण और त्रुटि द्वारा रासायनिक समीकरणों का संतुलन (निरीक्षण या परीक्षण द्वारा भी कहा जाता है)
- 1.2 रासायनिक समीकरणों के बीजगणितीय संतुलन
- 1.3 रेडॉक्स समीकरणों की रोलिंग (आयन-इलेक्ट्रॉन विधि)
- रासायनिक समीकरणों के संतुलन के 2 उदाहरण
- २.१ पहला उदाहरण
- २.२ दूसरा उदाहरण
- 2.3 तीसरा उदाहरण
- 3 संदर्भ
रासायनिक समीकरणों के संतुलन के तरीके
एक आधार के रूप में लेते हुए कि अभिकारकों और उत्पादों को जाना जाता है, और यह कि उनके सूत्र सही रूप से उस तरफ व्यक्त किए जाते हैं जो उनके अनुरूप है, हम निम्नलिखित विधियों के अनुसार समीकरणों को संतुलित करने के लिए आगे बढ़ते हैं।.
परीक्षण और त्रुटि (निरीक्षण या परीक्षण द्वारा भी कहा जाता है) द्वारा रासायनिक समीकरणों का संतुलन
यह प्रतिक्रिया के स्टोइकोमेट्री पर आधारित है और समीकरण को संतुलित करने के लिए विभिन्न गुणांक के साथ प्रयास करने की कोशिश करता है, जब तक कि छोटी से छोटी संभव पूरी संख्या को चुना जाता है जिसके साथ प्रत्येक तत्व के परमाणुओं की समान संख्या दोनों तरफ प्राप्त होती है। प्रतिक्रिया की.
एक अभिकारक या उत्पाद का गुणांक वह संख्या है जो इसके सूत्र से पहले होती है, और यह एकमात्र संख्या है जिसे समीकरण को संतुलित करते हुए बदला जा सकता है, क्योंकि सूत्रों के अंशों को बदलने से यौगिक की पहचान बदल जाएगी सवाल में.
गणना और तुलना करें
प्रतिक्रिया के प्रत्येक तत्व की पहचान करने और इसे सही पक्ष पर रखने के बाद, हम समीकरण में मौजूद प्रत्येक तत्व के परमाणुओं की संख्या की गणना और तुलना करते हैं और निर्धारित करते हैं कि संतुलित होना चाहिए.
फिर, हम प्रत्येक तत्व के संतुलन के साथ जारी रखते हैं (एक समय में), पूरे गुणांक को प्रत्येक सूत्र से पहले रखकर जिसमें असंतुलित तत्व होते हैं। आमतौर पर धातु तत्व पहले संतुलित होते हैं, फिर गैर-धातु तत्व और अंत में ऑक्सीजन और हाइड्रोजन परमाणु.
इस तरह, प्रत्येक गुणांक पूर्ववर्ती सूत्र के सभी परमाणुओं को गुणा करता है; इसलिए एक तत्व को संतुलित करते समय अन्य असंतुलित हो सकता है, लेकिन प्रतिक्रिया सही होने पर यह सही हो जाता है.
अंत में, यह एक अंतिम गणना द्वारा पुष्टि की जाती है कि संपूर्ण समीकरण सही ढंग से संतुलित है, अर्थात यह पदार्थ के संरक्षण के नियम का पालन करता है.
रासायनिक समीकरणों के बीजगणितीय संतुलन
इस विधि का उपयोग करने के लिए, रासायनिक समीकरणों के गुणांक के उपचार के लिए एक प्रक्रिया स्थापित की जाती है जिसे सिस्टम के अज्ञात के रूप में हल किया जाना चाहिए।.
सबसे पहले, प्रतिक्रिया के एक विशिष्ट तत्व को संदर्भ के रूप में लिया जाता है और गुणांक को अक्षर (ए, बी, सी, डी ...) के रूप में रखा जाता है, जो प्रत्येक अणु में उस तत्व के मौजूदा परमाणुओं के अनुसार अज्ञात का प्रतिनिधित्व करते हैं (यदि एक प्रजाति में वह तत्व नहीं होता है जिसे "0" रखा गया है).
इस पहले समीकरण को प्राप्त करने के बाद, प्रतिक्रिया में मौजूद अन्य तत्वों के लिए समीकरण निर्धारित किए जाते हैं; उक्त प्रतिक्रिया में जितने तत्व होंगे उतने ही समीकरण होंगे.
अंत में, अज्ञात को घटाने, बराबरी या प्रतिस्थापन के बीजीय तरीकों में से एक द्वारा निर्धारित किया जाता है और गुणांक प्राप्त होते हैं जो सही संतुलित समीकरण में परिणाम देते हैं.
संतुलन संबंधी समीकरण (आयन-इलेक्ट्रॉन विधि)
पहले सामान्य (असंतुलित) प्रतिक्रिया को इसके आयनिक रूप में रखा जाता है। फिर इस समीकरण को दो अर्ध-प्रतिक्रियाओं में विभाजित किया जाता है, ऑक्सीकरण और कमी, प्रत्येक को परमाणुओं की संख्या, उनके प्रकार और इन के आरोपों के अनुसार संतुलित करना.
उदाहरण के लिए, एसिड माध्यम में होने वाली प्रतिक्रियाओं के लिए, एच अणुओं को जोड़ा जाता है।2या ऑक्सीजन परमाणुओं को संतुलित करने के लिए और एच जोड़ें+ हाइड्रोजन परमाणुओं को संतुलित करने के लिए.
इसके विपरीत, एक क्षारीय माध्यम में एक समान संख्या में OH आयन जोड़े जाते हैं- प्रत्येक एच आयन के लिए समीकरण के दो तरफ+, और जहां H आयन उत्पन्न होते हैं+ और ओह- वे एच अणु बनाने के लिए एक साथ आते हैं2हे.
इलेक्ट्रॉनों को जोड़ें
फिर आपको प्रत्येक अर्ध-प्रतिक्रिया में मामले को संतुलित करने के बाद, आरोपों को संतुलित करने के लिए आवश्यक रूप से कई इलेक्ट्रॉनों को जोड़ना होगा.
प्रत्येक अर्ध-प्रतिक्रिया के रोलिंग के बाद, इन्हें परीक्षण और त्रुटि द्वारा अंतिम समीकरण को संतुलित करके जोड़ा जाता है। अगर दो अर्ध-प्रतिक्रियाओं के इलेक्ट्रॉनों की संख्या में अंतर होता है, तो इस संख्या के बराबर गुणांक द्वारा एक या दोनों को गुणा किया जाना चाहिए.
अंत में, यह पुष्टि की जानी चाहिए कि समीकरण में समान संख्या में परमाणु और एक ही प्रकार के परमाणु शामिल हैं, इसके अलावा वैश्विक समीकरण के दोनों किनारों पर समान शुल्क हैं।.
रासायनिक समीकरणों के संतुलन के उदाहरण
पहला उदाहरण
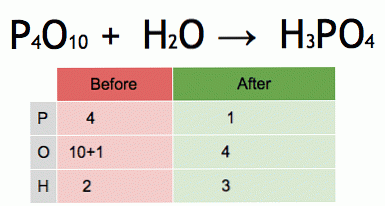
यह संतुलित रासायनिक समीकरण का एक एनीमेशन है। फास्फोरस पेंटोक्साइड और पानी फॉस्फोरिक एसिड में परिवर्तित हो जाते हैं.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
दूसरा उदाहरण
आपके पास ईथेन (असंतुलित) की दहन प्रतिक्रिया है.
सी2एच6 + हे2 → सीओ2 + एच2हे
इसे संतुलित करने के लिए परीक्षण और त्रुटि की विधि का उपयोग करते हुए, यह देखा गया है कि किसी भी तत्व में समीकरण के दोनों तरफ परमाणुओं की संख्या समान नहीं है। इस प्रकार, यह कार्बन संतुलन के साथ शुरू होता है, एक दो को स्टोइकोमेट्रिक गुणांक के रूप में जोड़ता है जो उत्पादों के किनारे पर होता है.
सी2एच6 + हे2 → 2CO2 + एच2हे
कार्बन दोनों तरफ संतुलित किया गया है, इसलिए हम पानी के अणु में तीन जोड़कर हाइड्रोजन को संतुलित करने के लिए आगे बढ़ते हैं.
सी2एच6 + हे2 → 2CO2 + 3H2हे
अंत में, चूंकि समीकरण के दाईं ओर सात ऑक्सीजन परमाणु हैं और यह अंतिम तत्व है जिसे अभी भी संतुलित किया जाना है, भिन्नात्मक संख्या 7/2 को ऑक्सीजन अणु के सामने रखा गया है (हालांकि पूरे गुणांक आमतौर पर पसंद किए जाते हैं).
सी2एच6 + 7/2 ओ2 → 2CO2 + 3H2हे
फिर सत्यापित करें कि समीकरण के प्रत्येक पक्ष में कार्बन परमाणुओं (2), हाइड्रोजन (6) और ऑक्सीजन (7) की समान संख्या है.
तीसरा उदाहरण
डाइक्रोमेट आयनों द्वारा लोहे का ऑक्सीकरण एक एसिड माध्यम में होता है (असंतुलित और इसके आयनिक रूप में).
धर्म2+ + सीआर2हे72- → आस्था3+ + सीआर3+
इसके संतुलन के लिए आयन-इलेक्ट्रॉन विधि का उपयोग करके, इसे दो अर्ध-प्रतिक्रियाओं में विभाजित किया गया है.
ऑक्सीकरण: विश्वास2+ → आस्था3+
कमी: Cr2हे72- → Cr3+
चूंकि लोहे के परमाणु पहले से ही संतुलित (1: 1) हैं, इसलिए चार्ज को संतुलित करने के लिए उत्पादों की तरफ एक इलेक्ट्रॉन जोड़ा जाता है.
धर्म2+ → आस्था3+ + और-
अब Cr के परमाणु संतुलित हैं, समीकरण के दाईं ओर दो जोड़ते हैं। फिर, जब एसिड माध्यम में प्रतिक्रिया होती है, तो सात एच अणु जोड़े जाते हैं।2या ऑक्सीजन परमाणुओं को संतुलित करने के लिए उत्पादों की तरफ.
सीआर2हे72- → 2Cr3+ + 7H2हे
एच परमाणुओं को संतुलित करने के लिए, चौदह एच आयनों को जोड़ा जाता है+ अभिकारकों की ओर से और, सामग्री को बराबर करने के बाद, एक ही पक्ष पर छह इलेक्ट्रॉनों के जोड़ द्वारा आरोपों को संतुलित किया जाता है।.
सीआर2हे72- +14h+ + 6e- → 2Cr3+ + 7H2हे
अंत में, दोनों अर्ध-प्रतिक्रियाएं जोड़ी जाती हैं, लेकिन चूंकि ऑक्सीकरण प्रतिक्रिया में केवल एक इलेक्ट्रॉन होता है, इसलिए यह सब छह से गुणा होना चाहिए.
6Fe2+ + सीआर2हे72- +14h+ + 6e- → आस्था3+ + 2ch3+ + 7H2ओ + 6 ई-
अंत में, इलेक्ट्रॉनों को वैश्विक आयनिक समीकरण के दोनों किनारों पर समाप्त किया जाना चाहिए, यह सत्यापित करते हुए कि उनका चार्ज और मामला सही तरीके से संतुलित है.
संदर्भ
- चांग, आर। (2007)। रसायन विज्ञान। (9 वां संस्करण)। मैकग्रा-हिल.
- हेन, एम।, और एरिना, एस। (2010)। कॉलेज रसायन विज्ञान की नींव, वैकल्पिक। Books.google.co.ve से लिया गया
- तुली, जी। डी।, और सोनी, पी। एल। (2016)। रसायन विज्ञान या रासायनिक समीकरणों की भाषा। Books.google.co.ve से लिया गया
- शीघ्र प्रकाशन (2015)। रसायन विज्ञान के समीकरण और उत्तर (स्पीडी स्टडी गाइड)। Books.google.co.ve से लिया गया


